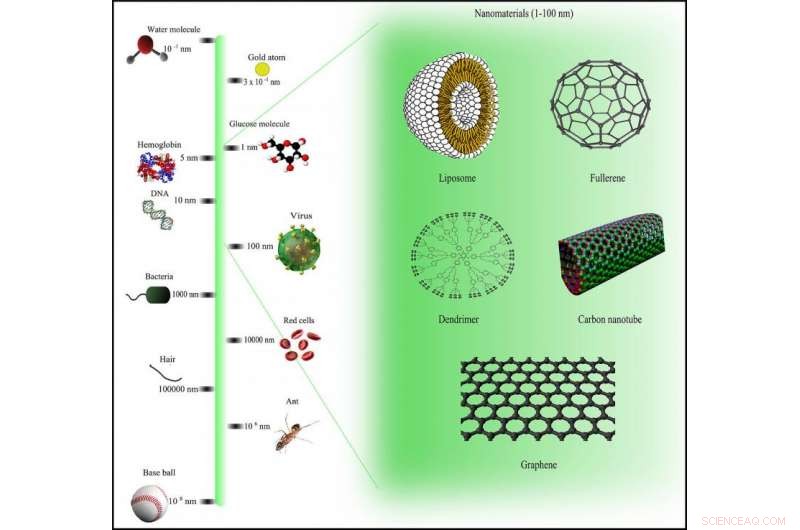
Nanomaterials jämförelse skala via Wikimedia Commons under CC BY-SA 3.0 licens
När du tar ett läkemedel, det färdas genom ditt blodomlopp, upplöses och sprids, och så småningom nå det avsedda målområdet.
Men eftersom blodet som innehåller läkemedlet färdas runt din kropp når bara en liten andel av initialdosen faktiskt önskad plats.
För receptfria läkemedel som paracetamol eller ibuprofen, med mycket få biverkningar, det här spelar inte så stor roll.
Men när det gäller cancerläkemedel, som kan påverka friska celler lika mycket som cancerceller, denna process kan orsaka stora problem.
Dels för att läkemedel späds ut i blodet, cancerpatienter måste ta dessa läkemedel i särskilt höga doser - och detta kan orsaka allvarligt obehagliga biverkningar.
Men professor Sonia Trigueros, meddirektör för Oxford Martin Program on Nanotechnology, är närmare att utveckla ett nanoskala läkemedelsleveranssystem i syfte att specifikt rikta cancerceller.
Arbeta med ett team av kemister, ingenjörer och fysiker, Trigueros har inlett ett ambitiöst uppdrag för att ta itu med cancer på nano -nivå - mindre än 100 nanometer bred. För sammanhang, detta är super-litet:en nanometer är en tusendels av en tusendels millimeter.
Det är fortfarande en lång väg kvar, men Trigueros gör anständiga framsteg, och har nyligen tacklat ett stort problem med att arbeta på nanonivå. Och på årets Wired Health -konferens - som tittade på hälsovårdens framtid, välbefinnande och genomik - hon berättade om sina senaste framsteg, och hennes framtidsvisioner.
På nanonivå
Några av oss kommer ihåg det periodiska systemet som visades i våra vetenskapliga klassrum som berättade om egenskaperna för varje element. Men när man arbetar på nanonivå förändras allt, och element beter sig helt annorlunda.
Element har andra egenskaper på nanonivå än de gör på mikronivå, förklarade prof Trigueros för Wired Health 2015 -publiken.
Detta innebär stora problem för forskare som försöker göra nanoskala enheter, som kan tillverkas av ett antal olika material, inklusive guld, silver och kol. Alla dessa material är mycket instabila på nanonivå.
"När du har gjort nanostrukturerna har du bara några minuter till ett par dagar att arbeta, "sa hon. De är verkligen instabila, speciellt när du lägger dem i vatten. "
Det här är inte perfekt, med tanke på att våra kroppar består till största delen av vatten.
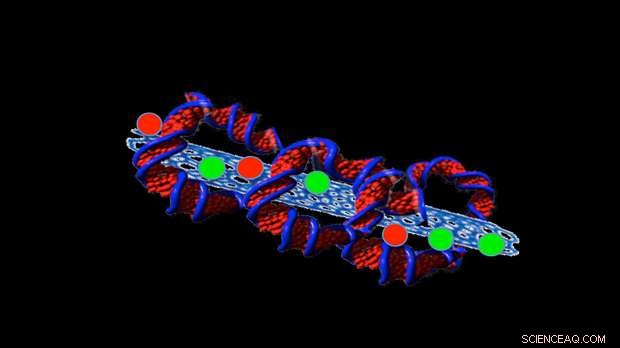
Upphovsman:Professor Sonia Trigueros
Trigueros senaste arbete har fokuserat på att försöka stabilisera små rör gjorda av kol, kallas kolnanorör, som håller läkemedel inuti röret så att de kan levereras till cancerceller.
Hon har nu hittat ett sätt att hålla dem stabila i mer än två år och i temperaturer upp till 42ºC.
Att göra detta, hon sveper DNA runt strukturerna, som en tortilla sveper runt fyllningarna i en burrito.
Även om detta uppnår målet att hålla nanostrukturerna stabila inuti kroppen gör det inte mycket nytta om DNA inte kan packa upp för att leverera drogerna. Men, enligt Trigueros, hon har visat att en gång inne i en cell, DNA:n rullar lätt upp och släpper ut sin nyttolast.
Verkligen riktad läkemedelsleverans
Så hur fungerar det hela? Hur kommer läkemedlen in i cancercellerna? Trigueros nanorör utnyttjar skillnaderna mellan cancerceller och friska celler - i detta fall skillnader i membranen som håller ihop dem.
"Cancerceller är mer permeabla än normala celler så att nanorören kan komma igenom cellmembranet. Och när de väl är inne, de packar upp och levererar droger, "förklarade Trigueros.
Att utnyttja skillnader i deras permeabilitet är ett sätt att rikta cancercellerna, men Trigueros förklarar att det finns mer än ett sätt att skapa ett riktigt riktat läkemedelsleveranssystem.
"Vi kan fästa vad vi vill på DNA, "sa hon." Så du kan fästa ett protein som känner igen cancerceller ".
Från teori till verklighet
Även om allt låter bra i teorin, kommer det verkligen att fungera i verkligheten?
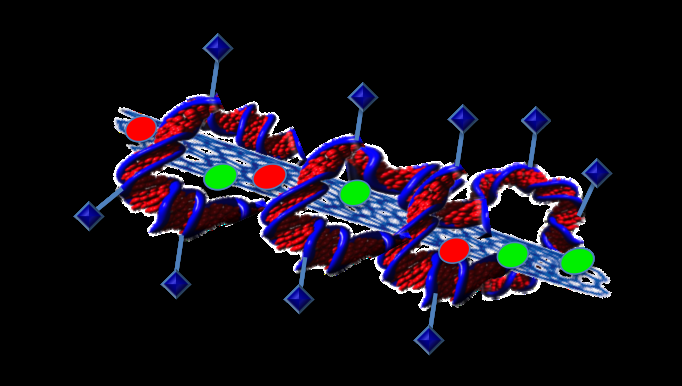
Att fästa proteiner till DNA kan skapa ett verkligt riktat läkemedelsleveranssystem. Upphovsman:Professor Sonia Trigueros
Trigueros har nu startat preliminära tester på laboratorieodlade lungcancerceller, berättade hon för oss under en intervju. Och detta har visat ett preliminärt löfte, hon säger, med hänvisning till opublicerade data om deras effektivitet vid dödande av dessa celler i labbet.
Andra är försiktigt optimistiska. "Det här är ett riktigt spännande perspektiv, "säger professor Duncan Graham, nanoteknikexpert och rådgivare till Cancer Research UK.
"Ett vanligt problem med kolnanorör är toxicitet, but when coated with DNA this concern could be removed, " he explains, "and it also addresses a fundamental issue, which is that they collect into clusters that become a solid mass and so are unable to leave the body."
I teorin, once Trigueros's nanotubes have finished their job they are tiny enough (50 nanometres) to be excreted through urine.
This isn't the first time carbon nanotubes have been used in cancer research:a US research team has used them, till exempel, to target and collect images of tumours in mice. But the combination of drug delivery and cancer-specific targeting is what interests Professor Graham.
"Unlike previous work using carbon nanotubes, this approach is set to target the tumour specifically, potentially meaning fewer side effects and a lower dosage. I look forward to seeing this in animal models which is where the real proof of activity lies, " han sa.
But he's cautious, stressing that Trigueros's work has not yet been peer-reviewed and published.
Nästa steg
Next Trigueros is aiming towards starting animal trials and, så småningom, she wants to begin clinical trials in patients – that is if everything goes well.
She hopes to focus on how nanostructures could be used to cross the blood-brain barrier – the brain's highly selective 'bouncer' that only lets certain molecules across. This has been notoriously difficult to get past, making targeting cancers in the brain more difficult.
But there is a still a long way to go and a lot of problems to tackle. In the shorter term, we'll be keeping an eager eye on her drug delivery research, as her ideas continue to develop.