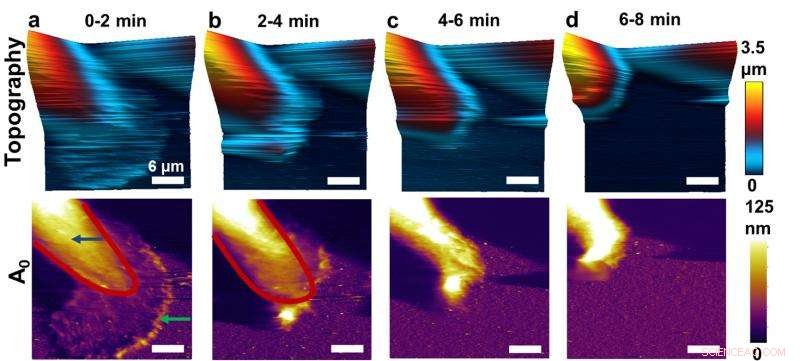
Denna sekvens av atomkraftmikroskopbilder (AFM) visar före och efter effekter av att hämma funktionen hos ett nyckelprotein i bröstcancerceller. Forskare som utvecklade en höghastighetsform av AFM har visat hur man avbildar de fysiska egenskaperna hos levande bröstcancerceller, avslöjar nya detaljer. Här, förändringar kan ses i cancercellernas egenskaper. Kredit:Purdue University bild/Arvind Raman
Forskare som utvecklade en höghastighetsform av atomkraftsmikroskopi har visat hur man avbildar de fysiska egenskaperna hos levande bröstcancerceller, för första gången avslöjar detaljer om hur deaktivering av ett nyckelprotein kan leda till metastaser.
De nya fynden ger också bevis för mekanismerna som är involverade i en cells svar på läkemedel mot cancer, sa Arvind Raman, Purdue Universitys Robert V. Adams professor i maskinteknik.
I atomkraftsmikroskopi (AFM), en liten vibrerande sond som kallas konsol passerar över ett material, exakt karakterisera dess topografi och fysikaliska egenskaper. Dock, tidigare har proceduren varit för långsam för att registrera några snabbt föränderliga biologiska processer i aktion.
"Innan detta framsteg kunde du bara se före och efter, men inte vad som hände däremellan, dynamiken i händelsen, ", sa Raman. "Det finns bevis baserat på detta arbete och våra tidigare upptäckter att det kan finnas en mekanisk signatur för läkemedelsresistens."
Avancerade modeller tillåter forskare att konvertera AFM-data till egenskaper om cellens interna byggnadsställningar, kallas det kortikala aktincytoskelettet, inklusive rörelsen av fibrer som kallas aktin.
Resultaten beskrivs i en artikel som publiceras måndagen (29 juni) i forskningstidskriften Vetenskapliga rapporter , Open Access-tidskriften för Nature Publishing Group. Forskarna använde tekniken för att studera bröstcancerceller, sondera ett nyckelenzym som kallas mjälttyrosinkinas, eller Syk.
Kinaser orsakar fosforylering av proteiner, en biokemisk process som kan förändra enzymer och spelar en betydande roll i en lång rad cellulära processer.
"Så om du stänger av kinaset, proteiner kommer att defosforyleras och sedan kan förändringar inträffa, sade Robert L. Geahlen, Erkänd professor i medicinsk kemi vid Purdue. "Vi kunde visa att avstängningen av detta kinas mycket snabbt förändrar cellens fysiska egenskaper. Så det är utan tvekan på grund av fosforyleringshändelserna som har omedelbara effekter på cytoskelettproteiner."
Uppsatsen skrevs av tidigare doktoranden Alexander X. Cartagena-Rivera, nu postdoktor vid National Institutes of Healths National Institute on Deafness and Other Communication Disorders (NIDCD); Purdue postdoktoral forskningsassistent Wen-Horng Wang; Geahlen; och Raman.
Forskarna studerade bröstcancerceller exponerade för en kemisk "inhibitor" som blockerar funktionen hos Syk, lämnar cellerna fria att metastasera. På grund av den nya högre hastigheten AFM, forskarna har för första gången kunnat observera vad som händer när hämmaren tillsätts.
Efter att ha tillsatt inhibitorn, aktinband sprider sig över cellen, får cellen att ändra form.
"Detta tar ungefär 10 minuter, vilket är ganska snabbt jämfört med många biologiska processer, sa Raman.
Bilderna kan tas med en hastighet av cirka 50 sekunder per bildruta.
"Innan vi gjorde det här skulle det ta ungefär 15 till 20 minuter att ta en bild, som är för långsam för att observera denna övergångsprocess, " han sa.
Band av aktin visades röra sig i en svepande rörelse över cellen.
"Du tänker på aktin som en byggnadsställning, men det är en dynamisk ställning, " sa Raman. "Vi kan se band av aktin som går runt och förändrar de fysiska egenskaperna under övergången, som inte förstods tidigare."
När Syk saknas eller avaktiveras, bröstcancerceller genomgår en process som kallas EMT, eller epitel-mesenkymal övergång, causing them to become highly motile and to undergo metastasis.
"If this kinase is in the cells, the cells cannot metastasize, so we've been trying to figure out what the mechanisms are by which you have to get rid of this kinase in order to become highly motile and metastatic, " said Geahlen, who is affiliated with the Purdue Center for Cancer Research. "And that's one of the reasons we were looking at this particular type of cancer cell with this particular form of Syk in it."
One goal of the research is to correlate physical properties of cells with tumor suppression and the action of the kinase on the cell.
The advance in AFM technology was accomplished by two innovations:as the cantilever scans a cell it bends differently depending on the properties of the material being scanned. A laser measures this "deflection, " and models convert the data to reveal information about the material's composition. Previous applications of AFM microscopy to study live cells provided feedback on the amplitude and frequency of the vibrating cantilever, but not the deflection. Dock, that approach takes too long to provide images of the quickly changing processes inside living cells. Providing feedback on the deflection instead has now been shown to increase the imaging speed 10-fold, making the method practical for studying cellular processes.
The other innovation is a technique that enables the cantilever to vibrate at two frequencies simultaneously.
"In one scan we can map the local physical properties of the cell, and we can do it fast enough that we compile maps of the changing cell, " Raman said.