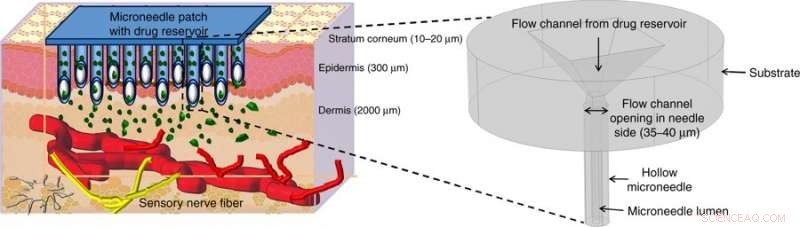
Illustrerad läkemedelstillförsel med hjälp av ihåliga mikronålar (MNs). Ihåliga MNs punkterar huden för att nå över de smärtavkännande nerverna i hudens transdermala region och släpper smärtfritt läkemedlet genom lämpliga aktiveringsmetoder. Figuren i början visar en förstorad vy av mikronålstrukturen som föreslagits i detta arbete. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9.
Mikronålar är utformade för att infundera mediciner transdermalt (genom huden) och relativt smärtfritt under kliniska applikationer. I en nyligen genomförd studie, Richa Mishra och hennes kollegor utvecklade en ny teknik för att omvandla polymerfilmer till en brottsäker glasartad form av kol för att utveckla mikronålar. Den optimerade transdermala läkemedelsleveransanordningen tillverkades med fotolitografi för att bilda en biokompatibel och robust mikronål för prekliniska applikationer.
Forskarna genererade först en rad vertikala, ihåliga rör tillverkade av den epoxibaserade polymeren SU-8 på ett silikonsubstrat. Mikrostrukturerna vässades till nålliknande former genom värmebehandling i en syrefri ugn och slutprodukten var helt sammansatt av slumpmässigt ordnade kolatomer. Efterföljande materialkarakterisering inkluderade nanoindentation för att mäta ytstyvheten. De glasartade kolstrukturerna var tillräckligt robusta för att penetrera mänsklig hud utan att gå sönder. Resultaten av studien publicerades på Mikrosystem och nanoteknik .
Författarna detaljerade den konventionella kol-mikroelektromekaniska systemet (C-MEMS) process som används för att tillverka mikronålarna. I processen, Mishra et al. använde ett skalbart och irreversibelt steg av pyrolys, där prekursorn till förmönstrade SU-8 mikronålar omvandlades till glasartade kolstrukturer. Experimenten utfördes i en inert atmosfär vid höga temperaturer (~900 0 C) att behålla sin ursprungliga form efter krympning. Vid omvandling till glasartat kol, mikronålarna ärvde de associerade egenskaperna för hårdhet, biokompatibilitet, termisk och kemisk beständighet.
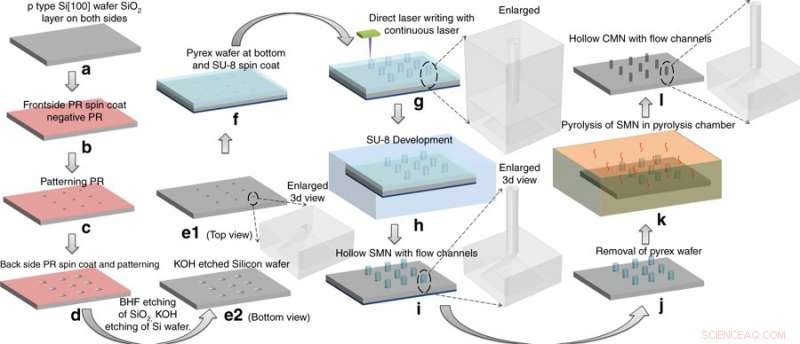
Tillverkningsprocess:omvandling av SU-8 mikronålar (SMN) till ihåliga glasartade kolmikronålar (CMN) genom pyrolys. SMN-strukturerna krympte samtidigt som de behöll sin övergripande geometri. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9
Forskarna jämförde hårdheten och Youngs modul för kol- och SU-8-mikronålarna för att förstå ökad styrka som induceras av C-MEMS-processen. Strukturell krympning av kolmikronålar vid pyrolys uppskattades därefter. Mishra et al. genomfört djupgående materialkarakterisering med energidispersiv röntgenspektroskopi (EDX) för att förstå ytkemi och Ramanspektroskopi för att uppskatta atomprocentandelen kol i mikronålens kristallina struktur.
Resultaten bekräftade mikronålarnas glasartade sammansättning. Ytterligare kompressions- och böjtester bestämde de maximala krafterna som mikronålarna kunde motstå. Enheterna kunde motstå krafter som var ungefär två storleksordningar högre än motståndskrafterna i huden. Enheterna testades därefter på hudytan av en musmodell i studien.
Användningen av kol i medicin är inte ny; exempel inkluderar tillämpningar i ortopediska leder, som kolfibrer/kompositer vid ortopediska operationer och som material i kirurgiska instrument. Egenskaperna hos kolfibrer för att bilda 3D-ställningsliknande strukturer har visat lovande kapacitet i benvävnadsregenerering. Kolets skräddarsydda egenskaper har gjort dem lämpliga för att tillverka transdermala mikronålar (MN) för läkemedels- och vaccintillförsel.
För kompetens, MN bör ha en optimal längd för effektiv läkemedelsleverans, men var tillräckligt kort för att undvika att orsaka smärta. Materialforskare undersöker strategier för att välja kliniskt genomförbara material och metoder som kan översättas kommersiellt på kort tid.
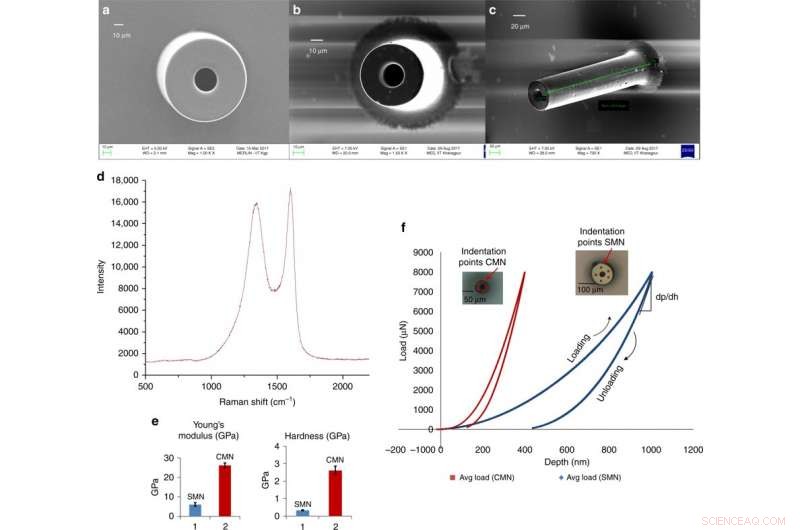
Glasartade mikronålar av kol för transdermal läkemedelstillförsel härledda från en skalbar C-MEMS-process. a) Svepelektronmikrofotografi av ett SMN (yttre diameter 100 μm, innerdiameter 50 μm). b) Motsvarande pyrolyserad MN. c) Lutad vy av samma CMN. d) Ramanspektrum för kolmikronålen. e) Jämförelse av Youngs modul och hårdhet för SU-8 och kol MN. f) Last vs. förskjutningsdata för ett SMN och motsvarande pyrolyserade CMN. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9.
Nyckelkraven för MN inkluderar biokompatibilitet, styrka och kontrollerad läkemedelstillförsel. Fasta MN kan utvecklas med polymerer, kisel, stål, titan och nickel via subtraktiva eller additiva processer. En nackdel med fasta MN är deras begränsade kapacitet för optimal läkemedelsleverans. Å andra sidan, ihåliga MN kan fästas på en läkemedelsreservoar med externt tryck för optimal läkemedelsleverans.
Mishra et al. valde prekursorn SU-8 för dess höga tvärbindningsstyrka, biokompatibilitet, låg kostnad, ljusinducerad polymerisation och kompatibilitet med den mikroelektroniska industriprocessen. För att tillverka ihåliga, glasaktiga kolmikronålar (CMNs), C-MEMS-processen anpassades först till mönster SU-8 mikronålar (SMN) med hjälp av direkt laserskrivning, följt av deras omvandling till glasartade CMN via pyrolys. Mikrofluidportar etsades i en kiselwafer, enligt ett tidigare protokoll utvecklat av samma forskargrupp. De resulterande produkterna (CMN) karakteriserades för sina mekaniska egenskaper, inklusive hårdhet och Youngs modul i jämförelse med deras prekursor-SMN. Resultaten visade att CMN var överlägsna.
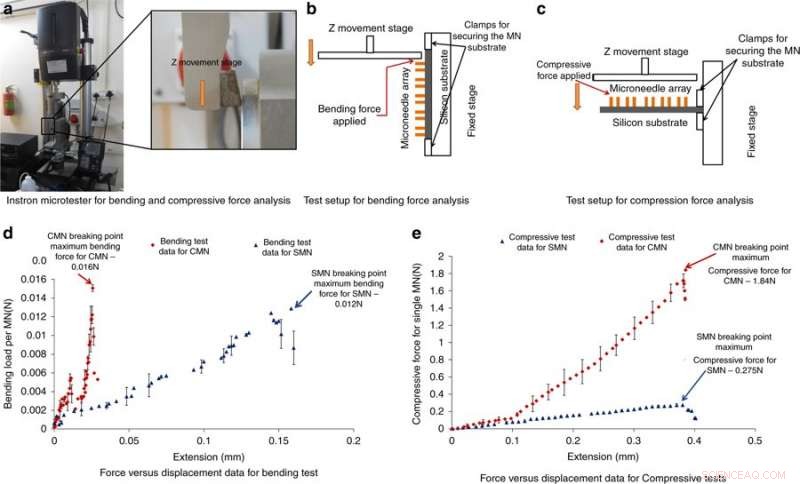
Instron mikrotester för böj- och tryckkraftanalys och resultat. a) Fotografi av Instron-mikrotestern som används för böjnings- och tryckkraftsanalys. b) Testuppställning för analys av böjkraft. c) Testuppställning för kompressionskraftanalys. d) Kraft kontra förskjutning resultat från böjningstestet. e) Kraft kontra förskjutning resultat från kompressionstestet. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9
Mishra et al. observerade och kvantifierade dimensionerna av SMN-prekursorer och motsvarande pyrolyserade CMN-strukturer med hjälp av svepelektronmikroskopi (SEM) bilder. Efter pyrolys, diametern och väggtjockleken på mikronålen minskade. EDX-resultaten visade ökad atomprocent av kolelement för kol-MN. Frånvaron av kväve i kolmikronålens sammansättning indikerade att den togs bort under uppvärmningen. Syrehalten i procent berodde på CMN-strukturen och Si/SiO 2 substratytan. Raman-spektroskopi visade den glasartade kristallina naturen hos den slutliga mikrostrukturen genom att verifiera kolprodukten. Resultaten stämde överens med tidigare studier.
Forskarna erhöll lastförskjutningsdata via nanoindentation för de separata SU-8- och kolstrukturerna. De beräknade hårdheten och elasticitetsmodulen med Oliver Pharr-modellen. Resultaten visade en hårdhet på 0,33 GPa och Youngs modul på 5,52 GPa för SMN. Vid konvertering till CMN via pyrolys, intryckningsresultaten visade högre elasticitet hos materialet, hårdheten ökade åtta gånger till 2,62 GPa och Youngs modul ökade 4,8 gånger till 26,97 GPa.
För att förstå förmågan hos MN att motstå krafter utan att gå sönder under införandet i huden, Mishra et al. genomfört böjnings- och tryckkraftsmätningar av strukturen. Vanligtvis, en MN upplever motstånd under hudpenetration, den applicerade kraften bör därför vara större än den motsatta kraften. För att testa böjning/kompression, MN:erna laddades till en Instron mikrotester och en metallplatta drevs mot MN:erna tills de gick sönder; om den applicerade belastningen var under den maximala tryck- eller böjkraften, nålarna går inte sönder. Ett kraftigt fall i tryckkraften eller böjkraften indikerade en brottpunkt. Resultaten visade att CMN var mycket starkare än prekursorerna, så att de kan övervinna motstånd under hudpenetration.
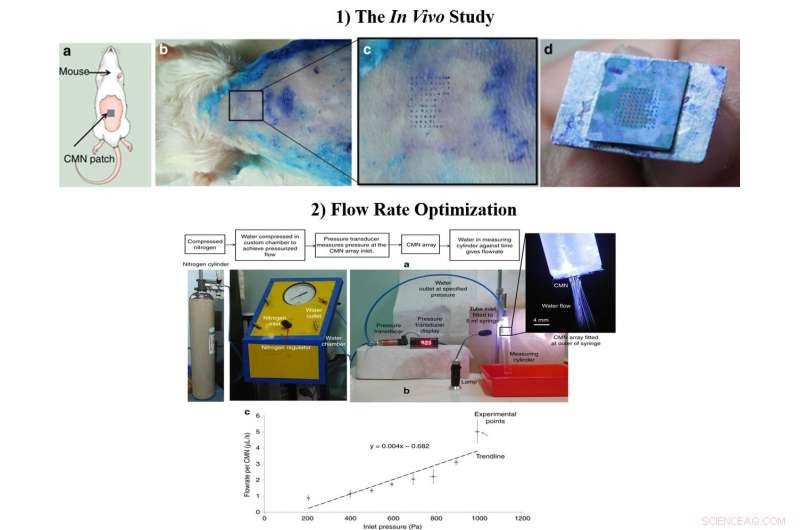
1) In vivo-studien a) Schematisk beskrivning av MN-insättningstestet på möss. b) Biologiskt insättningstest utfört på 6 till 8 veckor gamla schweiziska albinomöss. c) Förstorad bild av hudområdet genomborrat av CMN. d) Intakt array på 10 × 10 efter flera insättningar. 2) Den optimerade flödeshastigheten, a) Testuppställning för flödesmätning. b) Flödeshastighet per mikronål vid olika inloppstryck. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9
Efter att ha bekräftat den mekaniska karaktären och överlägsenheten hos ihåliga CMN i labbet, Richa Mishra och medarbetare genomförde experiment in vivo för att testa CMN på mushud. En mikronålsuppsättning nydoppad i metylenblått pressades på huden på en schweizisk Albino-musmodell och drogs långsamt ut flera gånger. Nålmärkena av metylenblått var synliga, MN:erna förblev intakta efter flera insättningar och ett 500 µm arrayavstånd var optimalt för ytterligare studier i labbet.
Forskarna optimerade flödesdimensioner under tillverkningsprocessen och inkluderade mikrofluidiska ledningar med reducerad storlek för förbättrad MN-funktionalitet. För att testa flödeshastigheterna, de fäste en 5-ml spruta med en anpassad kammare innehållande avjoniserat vatten. När forskarna mätte den genomsnittliga flödeshastigheten mot trycket för enskilda MN, resultaten visade att läkemedelstillförseln i slutändan kunde kontrolleras genom att modifiera inloppstrycket.
Den definitiva materialkarakteriseringstekniken i studien var nanoindentation, eftersom parametern kvantifierade ythårdhet och Youngs modul för att verifiera CMN:s överlägsenhet. Framtida arbete kommer att omfatta utveckling av kontrollerad läkemedelsleverans, med en mikropump och en läkemedelsreservoar integrerade i MN-designen. På det här sättet, forskarna strävar efter att utveckla avancerade läkemedels- och vaccintillförselsystem inom vården som är kostnadseffektiva, exakt och smärtfri för patienten.
© 2019 Science X Network