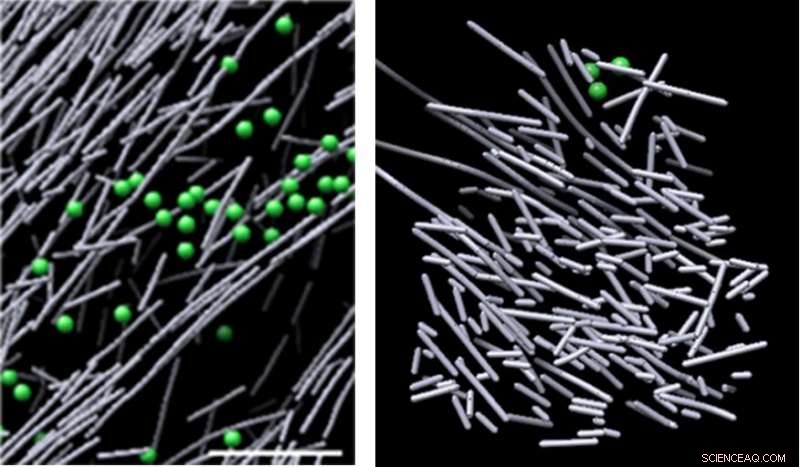
Kryoelektronmikroskopbilder av aktinmontering i cellen i frånvaro av en molekylär signal (vänster) och den höstacksliknande aktinfilament-nanoställningen som inducerades som svar på en molekylär signal (Rac1) och främjar cellrörelse (höger). Strukturen kom till synen i definierade regioner där Rac1 aktiverades, och försvann snabbt när Rac1-signaleringen slutade - på så lite som två och en halv minut. Kredit:Sanford Burnham Prebys Medical Discovery Institute (SBP)
Det finns många tillfällen då våra celler behöver röra sig. Mobila celler styr vår kropps bildning (embryonal utveckling). Immunceller strövar för att fånga oönskade inkräktare. Och helande celler (fibroblaster) migrerar för att laga sår. Men all rörelse är inte önskvärd:Tumörer är farligast när cancerceller får förmågan att resa genom hela kroppen (metastaser). Vissa bakterier och virus kan utnyttja cellernas motilitetsmaskineri för att invadera våra kroppar. Att förstå hur celler rör sig - och de stavliknande aktinfilamenten som driver processen - är nyckeln till att lära sig hur man stoppar eller främjar rörlighet för att förbättra människors hälsa.
Nu, använder ett av de mest kraftfulla mikroskopen i världen, forskare från Sanford Burnham Prebys Medical Discovery Institute (SBP) och University of North Carolina vid Chapel Hill (UNC-Chapel Hill) har identifierat en tät, dynamisk och oorganiserad aktinfilament nanoställning – som liknar en höstack – som induceras som svar på en molekylär signal. Detta är första gången forskare direkt har visualiserat, på molekylär nivå, en struktur som utlöses som svar på en cellulär signal – ett nyckelfynd som utökar vår förståelse för hur celler rör sig. Studien publicerades i Proceedings of the National Academy of Sciences av Amerikas förenta stater ( PNAS ).
"Cyro-elektronmikroskopi revolutionerar vår förståelse av cellers inre funktion, säger Dorit Hanein, Ph.D., senior författare till uppsatsen och professor i Bioinformatics and Structural Biology Program vid SBP. "Den här tekniken gjorde det möjligt för oss att samla robusta, 3-D-bilder av regioner av celler - liknande MRI, som skapar detaljerade bilder av vår kropp. Vi kunde visualisera celler i deras naturliga tillstånd, som avslöjade en aldrig tidigare skådad aktin-nano-arkitektur i cellen."
I studien, forskarna använde SBP:s kryoelektronmikroskop (Titan Krios), artificiell intelligens (AI) och skräddarsydda beräknings- och cellavbildningsmetoder för att jämföra nanoskaliga bilder av musfibroblaster med tidsstämplade ljusbilder av fluorescerande Rac1, ett protein som reglerar cellrörelser, svar på kraft eller påfrestning (mekanosensing) och patogeninvasion. Detta tekniskt komplexa arbetsflöde – som överbryggade fem storleksordningar i skala (tiotals mikron till nanometer) – tog åratal att utvecklas till sin nuvarande nivå av robusthet och noggrannhet och möjliggjordes genom experimentella och beräkningsinsatser från strukturbiologteamen vid SBP och biosensorteamet vid UNC-Chapel Hill.
Bilderna avslöjade en tätt packad, oorganiserad, ställningsliknande struktur som består av korta aktinstavar. Dessa strukturer kom till synen i definierade regioner där Rac1 aktiverades, och försvann snabbt när Rac1-signaleringen slutade – på så lite som två och en halv minut. Denna dynamiska ställning stod i skarp kontrast till olika andra aktinenheter i områden med låg Rac1-aktivering – vissa bestod av långa, inriktade stavar av aktin, och andra består av korta aktinstavar som förgrenar sig från sidorna av längre aktinfilament. Volymen som omsluter aktinställningen saknade vanliga cellulära strukturer, som ribosomer, mikrotubuli, vesiklar och mer, troligtvis på grund av strukturens intensiva densitet.
"Vi blev förvånade över att experiment efter experiment avslöjade dessa unika hotspots av oriktade, tätt packade aktinstavar i regioner som korrelerade med Rac1-aktivering, säger Niels Volkmann, Ph.D., en motsvarande författare till artikeln som ledde den beräkningsmässiga delen av studien, och professor i Bioinformatics and Structural Biology Programme vid SBP. "Vi tror att denna störning faktiskt är ställningens styrka - den ger flexibiliteten och mångsidigheten att bygga större, komplexa aktinfilamentarkitekturer som svar på ytterligare lokala rumsliga signaler."
Nästa, forskarna skulle vilja utöka protokollet för att visualisera fler strukturer som skapas som svar på andra molekylära signaler och för att vidareutveckla tekniken för att ge tillgång till andra regioner i cellen.
"Denna studie är bara början. Nu när vi utvecklade detta kvantitativa arbetsflöde i nanoskala som korrelerar dynamiskt signaleringsbeteende med nanoskalig upplösning av elektronkryotomografi, vi och ytterligare forskare kan implementera detta kraftfulla analytiska verktyg inte bara för att dechiffrera cellrörelsernas inre funktion utan också för att klargöra dynamiken hos många andra makromolekylära maskiner i en ostörd cellulär miljö, säger Hanein.
Hon tillägger, "Aktin är ett byggstensprotein; det interagerar med mer än 150 aktinbindande proteiner för att generera olika strukturer, var och en har en unik funktion. Vi har ett överskott av olika signaler som vi skulle vilja kartlägga, vilket skulle kunna ge ännu mer insikt om hur celler rör sig."