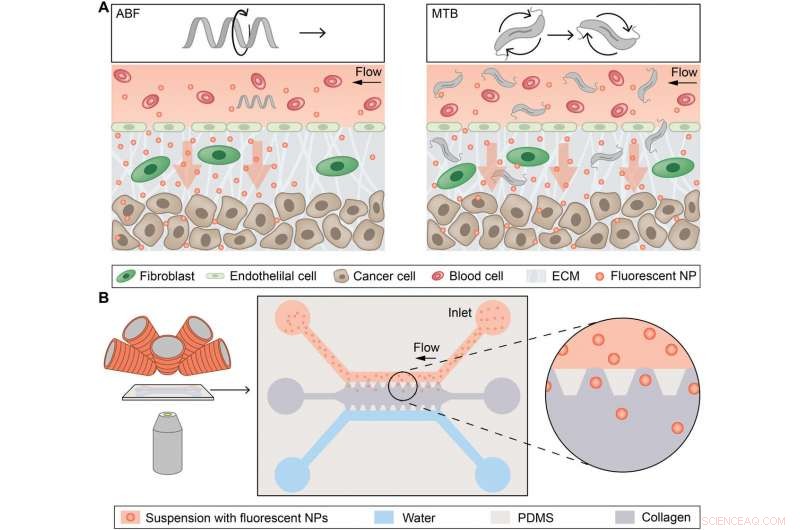
Konceptuell översikt av magnetiskt styrda mikropropellrar för konvektionsförstärkt NP-transport. (A) Konceptuellt schema som visar en enda mikrorobot, det artificiella bakteriella flagellumet (ABF), förbättra masstransport av nanopartiklar (NP) vid gränssnittet mellan kärl och vävnad (vänster), och svärmar av magnetotaktiska bakterier (MTB) som genererar konvektivt flöde för att förbättra masstransporten (höger). ECM, extracellulär matris. (B) Schematisk magnetofluidplattform för NP-masstransportstudier med hjälp av magnetiskt inducerad konvektion. Det mikrofluidiska chippet placeras mellan objektivlinsen på ett inverterat optiskt mikroskop och elektromagneterna (vänster). En schematisk bild visar chipet, bestående av en övre kanal fylld med NPs (röd) och en nedre vattenkanal (blå) som båda gränsar till en kollagenmatris (grå) längs begränsande trapetsformade stolpar gjorda av PDMS. NP kan passivt diffundera in i kollagenmatrisen längs deras koncentrationsgradient mot vattenkanalen. Kreditera: Vetenskapens framsteg , doi:10.1126/sciadv.aav4803
Nanopartiklar (NP) är en lovande plattform för läkemedelsleverans för att behandla en mängd olika sjukdomar inklusive cancer, hjärt-kärlsjukdom och inflammation. Ändå är effektiviteten av NP-överföring till den sjuka vävnaden av intresse begränsad på grund av ett urval av fysiologiska barriärer. Ett betydande hinder är transporten av NP för att exakt nå målvävnaden av intresse. I en nyligen genomförd studie, S. Schuerle och ett team av tvärvetenskapliga forskare vid avdelningarna för translationell medicin, Biofysik, Engineering Robotics, Nanomedicin och elektronik, i Schweiz, Storbritannien och USA utvecklade två distinkta mikrorobotbaserade mikropropellrar för att möta utmaningen.
De använde roterande magnetfält (RMF) för att driva enheterna och skapa lokal vätskekonvektion för att övervinna den diffusionsbegränsade transporten av nanopartiklar. Under det första experimentella tillvägagångssättet, de använde en enda syntetisk magnetisk mikrorobot som ett artificiellt bakterieflagell (ABF) och använde sedan svärmar av en naturligt förekommande magnetotaktisk bakterie (MTB) för att skapa en "levande ferrofluid" genom att utnyttja ferrohydrodynamiken. Genom att använda båda metoderna förbättrade forskarna transporten av NP i en mikrofluidisk modell av blodextravasation (förflyttning av ett läkemedel från blodkärl till den yttre vävnaden) och vävnadspenetration i mikrokanaler omgivna av en kollagenmatris för att skapa ett biomimetiskt gränssnitt mellan vävnad och kärl i labb. Resultaten av studien publiceras nu i Vetenskapens framsteg .
Nanopartiklar (NP) blir alltmer populära inom nanomedicin på grund av biomedicinsk forskningspotential som bärare av läkemedelsleveranser som överskrider gränserna för konventionell medicin. Medan NP är utformade för att förändra farmakokinetiken och biodistributionen av befintliga läkemedel, de hindras av fysiologiska barriärer, som förhindrar framgångsrik ackumulering vid sjukdomsställena, begränsa deras terapeutiska effekter in vivo. Under cancerbehandling, till exempel, läkemedelsbärare möter onormala kärl som omger tumörarkitekturen för ineffektiv intravenös läkemedelsfrisättning.
Eftersom leverans av NP till vävnader starkt påverkas av deras fysiokemiska egenskaper, forskare har omdesignat NP-formerna och -storlekarna för att optimera deras transportkinetik genom kärlväggarna för att nå vävnader. Forskare hade tidigare föreslagit flerstegsmetoder för optimerad läkemedelsleverans, antingen genom att krympa nanopartiklar i tid, eller fragmentera dem för att spridas och nå en plats av intresse först efter att ha stött på mikromiljömässiga tecken på sjukdom in vivo.

Det konstgjorda bakteriella flagellumet (ABF) i en mikrokärlliknande envätskeflödesanordning. Kredit:Science Advances, doi:10.1126/sciadv.aav4803
Rent generellt, NP-transport påverkas av ytladdning, hydrofobicitet och ytbiokemi; egenskaper som aktivt kan optimeras i forskningsarbetet för effektivare in vivo trafficking. Forskare har använt externa energikällor som magnetiska och akustiska krafter för att skapa trådlöst kontrollerade mikrobotar och överföra terapierna till sjuk vävnad för förbättrad diffusiv transport. Dock, dessa metoder förlitade sig fortfarande på diffus transport efter att ha släppt sin last ombord, medan behovet kvarstår av mer distinkta strategier för transport till en definierad plats.
I detta arbete, Schuerle et al. detaljerade två distinkta strategier för att generera trådlöst lokaliserat konvektivt flöde för att förhindra invasiviteten hos implanterade nanopartiklar. Inspirerad av området för mikrorobotar (mikrorobotar), forskarna använde (1) en enda, syntetisk, bakterieinspirerad mikrorobot, eller (2) stora svärmar av levande bakterier för att driva lokaliserad NP-transport. De konstgjorda och naturliga mikropropellrarna hjälpte processen genom att främja magnetiskt driven konvektion till en definierad plats i en magnetofluidisk uppsättning med potential för terapeutiska tillämpningar.
Den syntetiska mikroboten imiterade bakteriell framdrivning med hjälp av ett artificiellt bakterieflagellum (ABF), medan de täta svärmarna av magnetotaktiska bakterier (MTB) utnyttjade av Schuerle et al. förekom naturligt som gramnegativa prokaryoter ( Magnetospirillum magneticum ) med magnetiska egenskaper. Forskarna förväntar sig att resultaten kommer att övervinna befintliga transportbarriärer för förbättrad NP-vävnadspenetration via trådlös kontroll och rumsligt exakt lokal konvektion i framtiden.
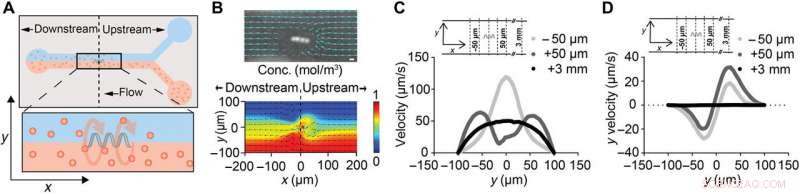
ABF stör lokalt vätskeflödet. (A) Schematisk över en 200 μm bred mikrofluidkanal med suspenderad ABF (36 μm lång, 10 μm i diameter) placerad i mitten av kanalen (x, y, z) =(0, 0, 0). Den övre kanalen innehåller vatten, medan den nedre kanalen innehåller 200 nm fluorescerande NP. (B) Ögonblicksbild av ABF i en 200 μm bred kanal som stör de spårade banorna för de 200 nm fluorescerande NP:erna som indikerar vätskeflöde. Skalstapel (överst), 10 μm. En numerisk simulering av tvåvätskeflöde med en ABF vid gränssnittet, med färg som indikerar koncentrationsfördelning (röd, 1 mol/m3; blå, 0 mol/m3) av molekylarter (botten). (C) Hastighetsprofil vid positioner uppströms och nedströms om ABF. För kontrollen, vid x =+3 mm, en oberörd laminär profil med en topphastighet på 50 μm/s simulerades. Vid både x =+50 μm (uppströms) och x =-50 μm (nedströms), en ökning av topphastigheter förutsägs, med toppen flyttad närmare kanalväggen för uppströmsfallet. (D) Simuleringsresultat för y-hastighetskomponenten uy (ortogonal mot och ut ur kanalen) vid samma positioner som (C). I närheten av ABF, ett tryck riktat ortogonalt mot flödesriktningen mot kanalväggen förutsägs. Kredit:Science Advances, doi:10.1126/sciadv.aav4803
Schuerle et al. konstruerade den magnetiska ABF med hjälp av tredimensionell (3-D) litografi och metalldeponering, som tidigare rapporterats. De bioinspirerade mikrorobotarna efterliknade den roterande flagellan för effektiv framdrivningsbaserad rörelse i mikroskalan – där trögflytande dragkrafter dominerar. De kontrollerade ABF-rörelsen med enhetliga magnetfält i 3D-rotation med hjälp av en trådlös magnetisk kontrolluppsättning som innehöll elektromagneter arrangerade runt en enda halvklot.
Sedan monterade de uppsättningen på ett inverterat mikroskop för att spåra de kontrollerade mikrorobotarnas rörelser. De roterande magnetfälten (RMF) tillät framdrivning och konvektivt flöde i den omgivande vätskan och när forskarna nedsänkte ABF i en suspension av fluorescerande NP, de observerade kontrollerat flöde för masstransport av NP.
I experimentet, de konstruerade det undre lagret av den mikrofluidiska kanalen för att innehålla 200 nm NPs liknande storleken som används i kliniska tillämpningar, medan de på det övre vätskeskiktet bibehöll en suspension av rent vattenhaltigt medium. Forskarna placerade ABF i mitten av installationen för att upprätthålla sin position mot flödet genom att kontrollera vätskeflödet i installationen. Detta arrangemang av ABF i en mikrofluidisk kanal störde det laminära flödet för att producera konvektion, som transporterade NP från vätskelagret i botten till det övre lagret - för att nå kanalväggen, dvs. platsen av intresse.
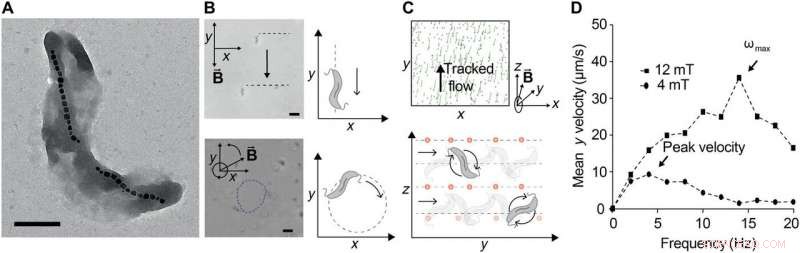
Ferrohydrodynamisk pumpning med kontrollerade svärmar av MTB. (A) Transmissionselektronmikrofotografi av M. magnetisk stam AMB-1. Skalstång, 0,5 μm. Magnetosomerna är tydligt synliga, här bildade i två distinkta strängar av järnoxidkristaller. (B) Kontroll av AMB-1 under statiska magnetfält (överst) och magnetiska fält som roterar i planet vid 1 Hz. Skalstapel (nederst), 5 μm. (C) Efterbehandlade bilder av spårade, medavstängd, omagnetisk, fluorescerande NP:er som används för att observera flödesfält som genereras av en svärm av MTB exponerad för ett 12-mT magnetfält som roterar vid 10 Hz i y-z-planet. Spår i grönt motsvarar tillryggalagda banor över 12 bildrutor (~1 s). Positionerna beräknas med ett bandpassfilter med 25 pixlars diameter, följt av toppfynd (överst). Bakteriell rörelse kan styras genom att ändra riktningen på vektorn för det roterande magnetfältet, eftersom MTB översätts inom rotationsplanet (botten). För en RMF-vektor runt x-axeln, bakterier roterar längs y, genererar ett flöde som transporterar NP längs y. (D) Translationshastighet plottas mot applicerad rotationsfrekvens vid två olika magnetfältstyrkor. Translationshastigheten ökar med frekvensen initialt, men vid tillräckligt höga frekvenser, det minskar eftersom det fluidiska dragmomentet övervinner det magnetiska vridmomentet för att hindra dem från att hänga med i fältets rotation. Den maximala synkroniserade frekvensen, som också motsvarar den maximala translationshastigheten, kallas utstegsfrekvensen ωmax. När magnetfältets styrka ökar, utstegsfrekvensen ökar, som observerats. Kredit:Science Advances, doi:10.1126/sciadv.aav4803
Forskarna utvecklade också en enkelvätskeflödesmodell i en mikrokanal för att bilda ett bioinspirerat mikrokärl med biomimetiska skalor och vätskeflödeshastigheter. Modellen innehöll koncentrerat kollagen i mitten som efterliknade den naturliga extracellulära matrisen. Använda enheten, Schuerle et al. kvantifierade fluorescensintensiteten i den biomimetiska matrisen för att testa om den magnetiskt kontrollerade ABF kunde förbättra masstransporten av fluorescensmärkta NP:er in i den vävnadshärmande matrisen. Resultaten visade att ABF var begränsade som en konvektiv mikropropller i mindre kärl, men detta kan ändras genom att skala ABF-strukturen för att passa kanalstorleken i framtiden.
Forskarna övervägde effekterna av en hel svärm av mindre mikrorobotpropellrar härnäst. För detta, Schuerle et al. valde vildtyp MTB-stammen AMB-1 ( Magnetospirillum magneticum ) för att bilda magnetosomer. Mikroorganismerna producerade naturligt kedjor av järnoxidpartiklar i lipiddubbelskikt i plasmamembranet för manipulerad rörelse med hjälp av externa magnetfält. Medan forskare hade använt MTB i tidigare studier som potentiella vehiklar för läkemedelstillförsel med externa magnetfält, Schuerle et al. använde rotationsmagnetiska fält (RMF) i detta arbete. RMF:erna tvingade en MTB-svärms rörelse för att driva deras rörelse via magnetiskt vridmoment.
Kontroll av grönt fluorescensmärkt MTB i mikrofluidisk enhet, när RMF är på/av. Kredit:Science Advances, doi:10.1126/sciadv.aav4803
Forskarna sänkte det genomsnittliga avståndet mellan bakterierna genom att använda en hög koncentration av MTB för att pressa cellgrannarna framåt i 3D-svärmar dominerade av hydrodynamiska krafter. De observerade inte klustring eller aggregering av MTB-magnetosomerna när de exponerades för RMF eftersom magnetosomerna i sig var skyddade av bakteriecellmembranen för kontrollerat vätskeflöde. Schuerle et al. upprepade experimenten för biomimik med hjälp av en mikrofluidisk enhet innehållande kollagen för att visa att MTB-svärmar kunde penetrera kollagen, när tillräckligt höga koncentrationer av MTB användes.
På det här sättet, använda två experimentella strategier Schuerle et al. förbättrade masstransporten av NP, via konvektivt flöde genererat av magnetiskt styrda mikropropellrar. Mikrorobotexperimenten visade att ABF efterliknade en bakteriell flagell för att hjälpa NP-ackumulering och penetration in i en tät kollagenmatris - när den påverkades av RMF. Schuerle et al. föreslå att sådana stationära ABFs inkluderas i stentar för att utlösa läkemedelsfrisättning och förbättra penetrationen på en plats av intresse för att motverka inflammation vid behov.
Med den andra strategin, de fokuserade på att generera samma teknik men med magnetotaktiska bakteriestammar (MTB). Baserat på det aktuella arbetet och de befintliga tumörhemmande egenskaperna hos MTB, forskarna föreställer sig magnetiskt kontrollerade svärmar av 3-D MTB:er för att transportera NP:er i interstitiell vätska i tumörmikromiljöer. Forskarna kommer att optimera tätheten av bakterier för en kompatibel dos in vivo och arbetet kommer att bana väg framåt för ytterligare studier av mikro- och nanomaterial för magnetiskt förbättrad NP-transport inom klinisk nanomedicin.
© 2019 Science X Network