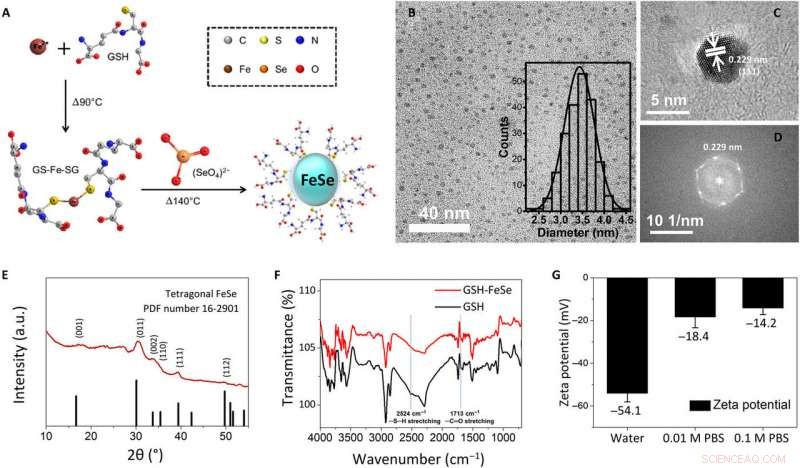
Fysikalisk-kemisk karakterisering av syntetiserade vattenlösliga FeSe QDs i en kruka. (A) Schematisk illustration av syntesförfarandet i en pott för GSH-kapslade FeSe QDs, (B) ljusfälts-TEM-bild (infogning:histogram för storleksfördelning), (C) högupplöst TEM-bild, (D) snabb Fourier-transform av högupplöst TEM-bild, (E) GIXRD-mönster, (F) FTIR-spektra, och (G) zetapotential för FeSe QDs. a.u., godtyckliga enheter. Kredit:Science Advances, doi:10.1126/sciadv.aay0044
Fotoluminescerande sonder med hög biokompatibilitet, kvantutbyte och multifotonabsorptionsprestanda är av betydande intresse vid biomedicinsk avbildning, förväntas uppnå förbättrat penetrationsdjup och rumslig upplösning. Järnselenid (FeSe) kvantprickar (QDs) rapporteras uppfylla dessa kriterier baserat på en ny rapport publicerad i Vetenskapens framsteg av J. Kwon och ett team av forskare vid de tvärvetenskapliga avdelningarna för kemi, Biomaterial Science och Cogno-Mechantronics Engineering i Korea och Kina. Kvantprickar är nanometerskaliga självlysande halvledarkristaller med unika kemiska och fysikaliska egenskaper i förhållande till deras struktur och sammansättning.
De syntetiska QDs i denna studie kan uppvisa två- och tre-foton excitationsegenskaper vid 800- och 1800 nm våglängder med ett högt kvantutbyte (40 procent) för andra fönsteravbildning. Materialen var också biokompatibla och verifierade av Kwon et al. när de kopplade poly(etylenglykol)-konjugerade QDs med human epidermal tillväxtfaktor receptor 2 (HER2) antikroppar för in vitro och in vivo tvåfotonavbildning. Forskarna avbildade framgångsrikt ytorna på ett djup av upp till 500 µm från hudytan med en olinjär femtosekundlaser vid en excitationsvåglängd på 800 nm. Fynden kan öppna en ny väg för att använda biokompatibla FeSe QDs för multifotonvävnadsavbildning under sjukdomsdiagnostik.
Övergångsmetallkalkogenider är attraktiva inom en rad forskningsområden inom nanovetenskap med tillämpningar som magnetiska halvledare, supraledare, solceller, elektrokatalysatorer, sensorer och kvantprickar. Järnbaserade material i lager är lovande supraledarekandidater med låg toxicitet och låg kostnad, med oväntat hög supraledande övergångstemperatur. Järnkalkogenidmaterial kan bli fluorescerande nanohalvledare när deras dimensioner minskar till noll. Dessa har unika optoelektroniska egenskaper som är relevanta för biologisk avbildning och solenergiomvandling. Fluorescerande biomedicinsk avbildning med halvledande nanokristaller är en lovande detektionsteknik på grund av hög fotostabilitet och avstämning av nanokristallerna under absorptions- och emissionsspektra jämfört med konventionella organiska färgämnen. QDs kan också uppvisa multiphoton-exciterad fotoluminescens (PL) där en luminofor samtidigt kan absorbera mer än två fotoner via ett virtuellt tillstånd för att avge synligt ljus.
Fenomenet kan tillåta större penetrationsdjup för minskad vävnadsautofluorescens och spridning med fördelar för in situ biomedicinsk fluorescensavbildning under cancerkirurgi. Forskare ser därför multifotonmikroskopi (MPM) som en icke-invasiv, in vivo, bildverktyg för djupa vävnader. I föreliggande studie, Kwon et al. motiverades av föregående arbete för att syntetisera biokompatibla QD:er med två- och tre-foton luminescerande egenskaper med hjälp av järn (Fe) och selen (Se) element. I allmänhet, de två (Fe- och Se-prekursorerna) förekommer naturligt i människokroppen och uppvisar låg toxicitet i nanopartikelform. Forskargruppen testade in vitro tumörcells-inriktningsspecificitet med humaniserad monoklonal HER2-antikropp (human epidermal tillväxtfaktorreceptor 2)-konjugerad järnselenid (FeSe) kvantprickar (anti-HER2-QDs). För in vitro-experimenten, de använde en HER2-överuttryckt MCF-7 (Michigan Cancer Foundation) xenograftmodell (transplantat från en annan donatorart) av bröstcancercellinje. De genomförde sedan in vivo MPM (multifotonmikroskopi) avbildning i en levande xenograftmodell av mänsklig brösttumör.
För att utveckla de vattenlösliga FeSe QDs, forskarna använde en syntetisk strategi i en pott. De bildade QDs med en storlek på ungefär 3,4 ± 0,3 nm och observerade dem med ljusfältstransmissionselektronmikroskopi (TEM). Genom att använda högupplösta TEM- och elektrondiffraktionsmönster för QD, de observerade planet av tetragonal FeSe. Forskarna använde strukturanalys med en betesincidens röntgendiffraktionsspektrometer (GIXRD) och röntgenfotoelektronspektroskopi för att noggrant bevisa morfologin hos FeSe QDs. Zeta-potentialtester visade att FeSe QDs löstes i avjoniserat vatten och i 0,01 M samt 0,1 M fosfatbuffert (PBS) saltlösning. När Kwon et al. övervakade dem med en digitalkamera och fluorescerande mikroskopi efter fem dagar, QDs aggregerade inte eller skilde sig i fluorescens. Bandgapet för FeSe QDs ungefärliga 2,44 eV från ultraviolett till synligt (UV-Vis) spektrum.
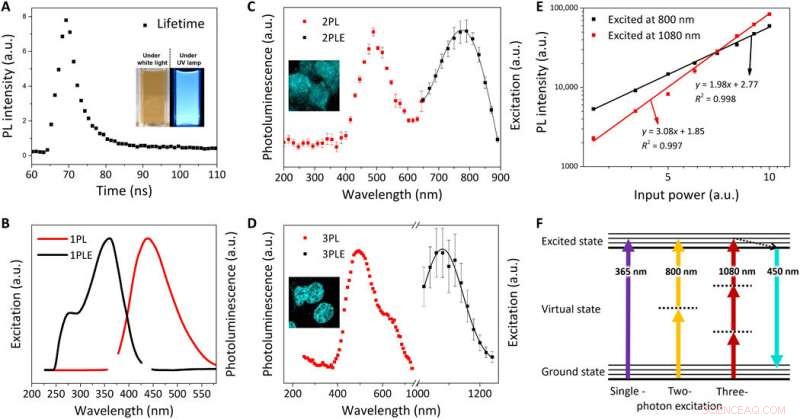
Optisk karakterisering av FeSe QDs. (A) PL-livslängd (τ) för FeSe QDs vid en excitationsvåglängd på 380 nm; infälld:digitala bilder av FeSe-spridning under vitt ljus och UV-lampa (λex =365 nm). Normaliserat PL-excitationsspektrum (PLE) (svart linje) och PL-spektrum (röd linje) vid λem på 440 nm och λex av (B) 365 nm för 1PL, (C) 800 nm för 2PL, och (D) 1080 nm för 3PL. (E) Effektberoende av PL-intensitet för 2PL (svart fyrkant) och 3PL (röd fyrkant). Lutningen för effektberoende funktionen är 1,98 och 3,08 för 2PL och 3PL, respektive. (F) Jablonski-diagram av singel-, två-, och tre-fotonluminescens. Kredit:Science Advances, doi:10.1126/sciadv.aay0044
Kwon et al. utforskade fotoluminescensegenskaperna (PL) hos FeSe QDs vid 25 grader C för att observera en livstid på 3,23 nanosekunder (ns). De noterade en två-foton (2PL) och tre-foton (3PL) exciterad PL, följt av representativa fluorescensmikroskopiska bilder av MCF27-celler färgade med FeSe QDs från 2PL och 3PL. Denna multifotonexciteringsegenskap är känd för bioavbildning med en längre våglängd som kan penetrera ett maximalt vävnadsdjup med reducerad fototoxicitet, observeras inom det "gyllene fönstret" under hjärnvävnadsavbildning.
Forskargruppen testade först QD-inverkan på cellviabilitet innan de applicerade FeSe QDs på bioavbildningsexperiment. De använde olika cellinjer odlade med olika koncentrationer av FeSe QDs vid olika odlingsperioder och observerade utmärkt livsduglighet efter sju dagar, med> 75 procent cellviabilitet. Med hjälp av fluorescensmikroskopiska bilder av cellkulturerna, Kwon et al. registrerade den överlägsna biokompatibiliteten hos FeSe QDs, där kvantprickarna inte stör celltillväxten. För att ytterligare minimera ospecifik bindning under monteringen, forskarna inkapslade FeSe QDs med poly(etylenglykol) (PEG) innan konjugering med HER2-antikroppar för att utveckla anti-HER2-PEG-QDs.
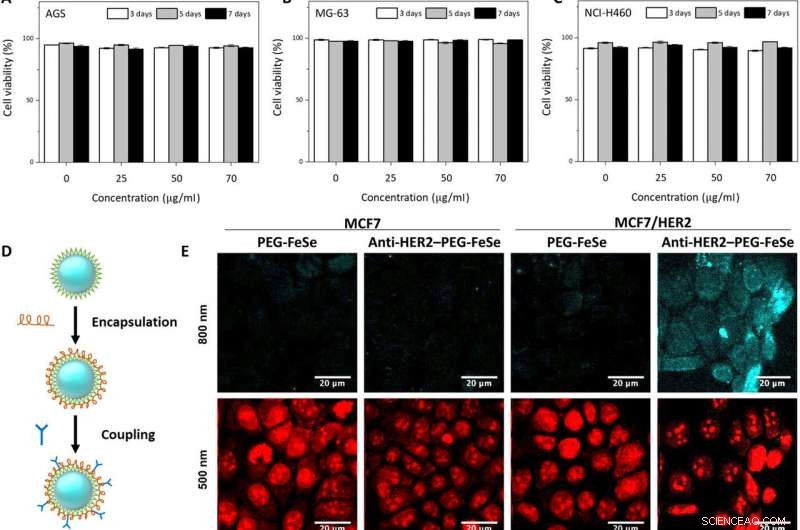
In vitro och in vivo tvåfotonmikroskopisk avbildning av FeSe QDs riktade mot brösttumör. Flödescytometriutvärdering av viabiliteten av (A) AGS, (B) MG-63, och (C) NCI-H460-celler exponerade för QDs i olika koncentrationer (0, 25, 50, och 70 μg ml−1) för 3, 5, och 7 dagar. (D) Konjugeringsprocedur för att förbereda anti-HER2–PEG-QDs. (E) In vitro tvåfotonmikroskopisk avbildning av MCF7 och HER2-överuttryckta MCF7-celler (MCF7/HER2) färgade med PEG-belagda FeSe QDs eller anti-HER2-konjugerade PEG-QDs (anti-HER2–PEG-QDs, 2 μg ml−1), där kärnorna färgades med propidiumjodid, och cellmembranet och kärnorna avbildades vid λex på 800 och 500 nm. Lasereffekt =40 mW vid fokalplanet. (F) Jämförelse av fotostabiliteten för QDs och rhodamine 6G (Rh6G) i avjoniserat vatten under två-fotonexcitation (λex =800 nm, lasereffekt =50 mW), där relativ PL-intensitet övervakades under 30 min. (G) Digitalt fotografi av tumörxenograft för in vivo-avbildning. (H) MPM-system. CH PMT, kanalfotomultiplikatorrör; OPO, optisk parametrisk oscillator. (I) In vivo MPM-bilder före och efter anti-HER2-QD-injektion och (J) in vivo MPM-bilder vid olika bränndjup (450 till 500 μm). Skala staplar, 20 μm. Kredit:Science Advances, doi:10.1126/sciadv.aay0044
Teamet testade det ospecifika upptaget och selektiviteten hos konjugaten under målinriktning på humana bröstcancerceller via propidiumjodidfärgning. Anti-HER2-PEG-QDs riktade sig specifikt mot HER2-receptorerna, indikerar potentialen att använda PEGylerade QDs som avbildningsmedel in vivo. De fysiologiskt stabila molekylerna bibehöll sina optiska egenskaper under sju dagar i serum och i en mängd olika buffertlösningar. FeSe QDs var mycket fotostabila under två-foton excitation med ytterligare egenskaper lämpade för biologisk avbildning och långtidsspårning av målceller.
Studien erbjöd ett nytt perspektiv för diagnos av bröstcancer. Bröstcancer är den näst största orsaken till cancerdöd för kvinnor, med betydande återfallsfrekvens, där minimalt invasiv kirurgi med hjälp av avkännings- och bildtekniker är avgörande för att identifiera sjukdomen. Forskargruppen etablerade en in vivo MPM (multifotonmikroskopi) avbildningsmetod med intravenös injektion av anti-HER2-PEG-QDs i en MCF xenograft djurmodell. De etablerade sedan en subkutan xenograft-musmodell av bröstcancer genom att injicera MCF7-celler och MCF/HER2-celler i flanken av möss. Efter fyra veckor, när tumörvolymen nådde 200 mm 3 , forskarna injicerade 100 µL anti-HER2-PEG-QDs och observerade FeSe QDs som en magentafärgad signal. De fick sedan 2PL-signaler på olika djup över tumörområdet med jämna mellanrum. Den andra harmoniska generationens (SHG)-signalen verkade blå för att representera kollagen i det ytliga området och forskarna skiljde PL-signalen från QD nära bröstcancercellerna.
På det här sättet, J. Kwon och kollegor syntetiserade biokompatibla FeSe QDs med stark cellviabilitet vid ökade QD-koncentrationer. Teamet använde QDs under två- och tre-fotonfluorescensavbildning och med multifotonavbildning på ett djup av upp till 500 µm för att övervaka tumörceller med en ickelinjär femtosekundlaser i levande djur in vivo. De kombinerade biokompatibla FeSe QDs och multifotonavbildning kan öppna en ny metod för att realisera icke-invasiv in situ bioavbildning inom levande försökspersoner.
© 2019 Science X Network