Kredit:Unsplash/CC0 Public Domain
I människokroppen, proteiner förekommer ibland i fibrillära aggregat som kallas amyloider. Även om vissa amyloider är kända för att ha en biologisk funktion, amyloidbildning är ofta förknippad med patologier, inklusive Alzheimers och Parkinsons sjukdomar. Att förstå hur exakt amyloidfibriller bildas är avgörande för att få insikter i utvecklingen av sådana sjukdomar och för att gå vidare med behandlingsmetoder.
Nu, Takahiro Watanabe-Nakayama från Kanazawa University, Kenjiro Ono från Showa University, och kollegor har undersökt bildningsprocessen av speciella amyloidfibriller med hjälp av en teknik som möjliggör visualisering av tillväxt över tid. Forskarna tittade specifikt på effekten av att korsså ('blanda') olika proteiner som bildar aggregat, och fann variationer i töjningshastigheter och fibrillernas struktur.
Forskarna studerade alfa-synuklein, ett protein som är rikligt i den mänskliga hjärnan. De tittade på vad som hände när man lät vildtyps-alfa-synukleinmolekyler - de naturliga, vanligaste varianten – bildar aggregat, och även hur aggregering är annorlunda när man introducerar (korssådd) mutantvarianter associerade med Parkinsons sjukdom. Dessutom, forskarna undersökte påverkan av pH-nivån i mikromiljön där fibrillväxt äger rum.
Med hjälp av höghastighets atomkraftsmikroskopi (HS-AFM), Watanabe-Nakayama, Ono och kollegor kunde spela in fibrilaggregation vid nanometerupplösning och hög videohastighet för olika fall. Först, forskarna tittade på tillväxten av enstaka varianttyper (självsådd). De fann att mutanter producerade fler aggregat, eller att de aggregerade snabbare vid neutralt pH än vildtypsvarianterna. En annan observation var att töjningen var snabbare vid lägre pH (5,8, dvs surt) än vid högre pH (7,4, dvs grundläggande).
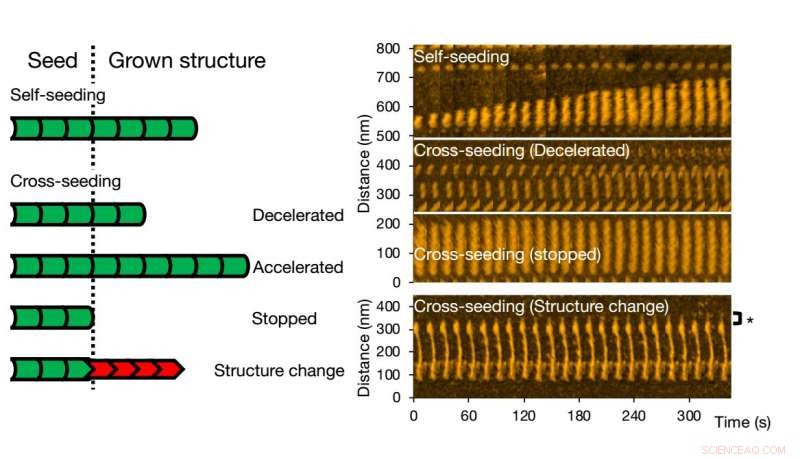
Höghastighets atomkraftsmikroskopi möjliggör visualisering och analys av fibrillbildning av varianter av ett enda protein. Kredit:Kanazawa University
För korssådd, olika scenarier kan uppstå. Fibriltillväxt kan påskyndas eller bromsas, eller till och med slutat. Det ursprungliga fröets morfologi kan bevaras, men det händer också att strukturen hos den resulterande fibrillen är annorlunda - typiska strukturella former är 'raka' eller 'spiralformiga'. Forskarna kontrollerade att fibrillstruktur och dynamik som observerats med HS-AFM motsvarar processerna i lösning med hjälp av fluorescensexperiment; liknande slutsatser erhölls.
Fynden av Watanabe-Nakayama, Ono och kollegor är relevanta för att bättre förstå amyloidrelaterade sjukdomar. Citerar forskarna:"Korssådd kombinerat med variationer i förlängningshastigheter har effekten att öka den strukturella mångfalden av de resulterande sammansättningarna. Denna mångfald kan återspeglas i distinkta neurotoxiska effekter för olika [protein] sammansättningar."