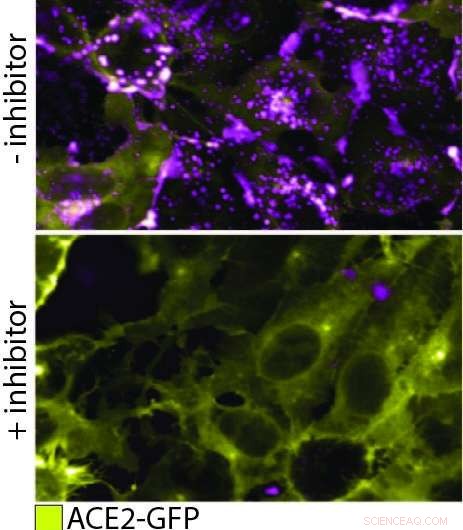
QD608-RBD binder ACE2 och inducerar endocytos. I denna figur, den övre panelen visar ACE2-GFP (gul) uttryckande celler som binder och internaliserar QD608-RBD (magenta). I den nedre panelen, en inhibitor tillsätts för att förhindra bindning av QD608-RBD till ACE2-GFP, och närvaron av ACE2-GFP på cellytan är stark med lite eller inget synligt QD608-RBD. Kredit:NCATS
"Vad vi gör här är faktiskt att visualisera bindningen av spiken till ACE 2 [angiotensinomvandlande enzym 2], " säger Kirill Gorshkov, en forskare vid National Center for Advancing Translational Sciences (NCATS) i Maryland, U.S.
Även om detta kan låta ofarligt för den oinvigde, denna bindning är det första steget i en process av viral spridning som kan ha lett till den värsta pandemin i minnet. "Spiken" är ett protein på SARS-CoV-2-viruset som är allmänt erkänt som det primära attackvapnet för att mobilisera dess virala DNA in i en värdcell. ACE2-receptorerna är humana cellproteiner som effektivt öppnar dörren för denna attack. Med hjälp av biokonstruerade kvantprickar, Gorshkov och Eunkeu Oh vid Naval Research Laboratory (NRL) i Washington, D.C., och deras kollegor kunde avbilda bindningen och efterföljande internalisering som äger rum när ACE2 och spikproteinet interagerar. "Du kan faktiskt se det hända i realtid, " tillägger Gorshkov, "Det är det fina med denna analys och det är därför vi tror att det kommer att vara viktigt för drogscreening."
Ett virus kan inte föröka sig utan att registrera en värdcell, så forskare runt om i världen har arbetat för att förstå hur SARS-CoV-2 interagerar med och penetrerar celler i syfte att blockera detta stadium och förhindra uppkomsten av COVID19. Gorshkov och hans kollegor vid NCATS arbetade redan med olika bildanalyser för cancer, virus och lysosomala lagringssjukdomar, "men när coronaviruset slog till, vi fick snabbt växla, säger Gorshkov.
Tidigare SARS-forskning hade belyst vikten av interaktioner med ACE2 i mänskliga celler för spridningen av denna typ av virus, och de kunde redan märka dessa receptorproteiner med ett grönt fluorescerande protein för att avbilda deras rörelser. Bevis ackumulerades också för att lokalisera de specifika spikproteinerna på SARS-CoV-2 som kan låsa ACE2 i ett fäste så att viruset kan komma in i cellen. Dock, information om spike proteininteraktioner har mestadels kommit indirekt från biokemiska eller närhetsanalyser och tester med proteiner och delar av proteiner tagna från viruset - "pseudo-viropartiklar." Utan fluorescerande märkning av dessa virala proteiner, deras roll i ACE2-receptorbindningen och efterföljande internalisering - endocytos - fortsatte att spela ut effektivt i skydd av mörkret till bildbehandling.
På NRL, Forskare var också angelägna om att utnyttja sin expertis med nanopartiklar för cellulär leverans och biosensing för att hjälpa ansträngningar att leta efter anti-COVID19-läkemedel. Oh började undersöka möjliga sätt att tillämpa de protein-nanostrukturkonjugeringstekniker hon hade arbetat med i över 15 år. Med två proteiner som delar en bindningsaffinitet - en kvantprick fäst vid den ena och en fluorescerande nanopartikel fäst vid den andra - kommer bindning mellan de två proteinerna att föra nanostrukturerna tillräckligt nära för energiöverföring mellan dem.
Den resulterande fluorescenssläckningen gör det sedan möjligt för forskarna att övervaka proteinbindningen. "Om du har någon hämmare i mitten för att stoppa bindningen, detta kan användas som en hämningsanalys för läkemedelsscreening, så vi använder det här mycket, " förklarar Oh. Ser den potentiella applikationen för screening av antikroppar mot COVID19, Oh och hennes team ledd av Mason Wolak presenterade sina idéer för teamet på NCATS, och de två institutionerna började arbeta för att utveckla det ytterligare.
Utveckla ett "pseudovirion"
Det första steget från Ohs sida av samarbetet var att utveckla ett "pseudovirion" med de potenta delarna av SARS-CoV-2 spikproteiner (där den receptorbindande domänen är belägen) fästa vid kvantpunkten på ett sådant sätt att spikproteinerna fortsätta att attackera och penetrera celler precis som ett aktivt virus. För detta, orienteringen av spikproteinerna och formen på pseudovirion var nyckeln, och här, Ohs omfattande erfarenhet av att konjugera aktiva proteiner till nanostrukturer lönade sig. Innan du går vidare till de dyrare cellulära leveranstesterna, de var tvungna att testa om deras pseudovirion fungerade utanför cellerna genom att konjugera fluorescerande guldnanopartiklar till ACE2-receptorerna och övervaka fluorescenssläckning. Åh listar de multipla förhållandena mellan protein och kvantprick, kvantprickstorlekar och ytkemi de provade innan de äntligen kunde observera fluorescenssläckning på proteinbindning, och var redo att skicka pseudovirion till Gorshkovs team "för att göra coola saker med den riktiga cellen."
För att observera pseudovirion som interagerar med ACE2 i en riktig cell, kvantpunkten på pseudovirion behövde nu konstrueras för att emittera vid en våglängd som var lätt att skilja från det gröna fluorescerande proteinet på ACE2, i motsats till att optimera nanopartikelsläckning. Med de två tydliga signalerna, teamet vid NCATS kunde spåra bindningen av de två proteinerna och efterföljande endocytos. Dessutom, de kunde se att bindningen och endocytosen förhindrades i närvaro av två testantikroppar. De kunde till och med testa endocytosmekanismen, som fortskrider med hjälp av ett protein som heter dynamin. När de lade till Dyngo-4a, som avbryter dynamin, de kunde se bindningen ske men ingen efterföljande endocytos.
Resultaten visar också en framgång för fjärrforskningssamarbeten, eftersom lagen faktiskt aldrig möttes. "Den typ av samarbete vi har här är sällsynt, säger Gorshkov, speglar hur mycket deras framsteg överträffade tidigare samarbeten där det hade varit ett större antal fysiska möten och samordnade aktiviteter. "Det var ett sådant driv och ett sådant fokus från båda grupperna att det verkligen fungerade väldigt bra."
Quantum dot pseudovirion är begränsat till avbildning av cellpenetration genom endocytos, och det återstår att fastställa om denna mekanism träder i kraft för alla celltyper, lungvävnad i synnerhet. En alternativ SARS-CoV-2 attackmekanism är baserad på membranfusion, och att avbilda detta med quantum-dot pseudovirion skulle kräva betydande modifieringar för att interagera med cellen mer som ett membran. Dock, den snabba genomströmning och direkta observationer som kvantprick-pseudovirion möjliggör bör utgöra betydande fördelar i sökandet efter antikroppar.
© 2020 Science X Network