
Nanomekaniska egenskaper hos ILQINS fibriller. a) AFM-höjd, b) 3D AFM-höjd, c) AFM-amplitud, och d) AFM DMT-modul för ILQINS-fibriller. e) DMT-modul för ILQINS-fibriller från del (d). f) Histogrammet för DMT-moduler för ILQINS-fibriller. Kreditera: Avancerad vetenskap , doi:10.1002/advs.202002182
Amyloider hänvisar till onormala fibrösa extracellulära och proteinhaltiga avlagringar som finns i organ och vävnader som bildar olösliga konstruktioner som är resistenta mot nedbrytning. Deras bildning kan åtfölja sjukdom, där varje sjukdom kännetecknas av ett specifikt protein eller peptidaggregat. De nanomekaniska egenskaperna hos amyloidfibriller och nanokristaller beror på deras sekundära och kvartära struktur och intermolekylära geometri. Forskare har använt avancerade avbildningsmetoder inklusive atomkraftsmikroskopi (AFM) för att reda ut den morfologiska och mekaniska heterogeniteten hos amyloider, även om det är svårt att få en fullständig förståelse baserad på konventionella spektroskopiska metoder.
I en färsk rapport som nu publicerats den Avancerad vetenskap , Jozef Adamcik och ett internationellt team av forskare vid ETH Zürich, University of Cambridge, universitetet i Luxemburg och universitetet i Shanghai, demonstrerade kombinerade enmolekylära nanospektroskopimetoder. De kombinerade teknikerna med atommodellering för att förstå den strukturella övergången av amyloidfibriller till amyloidmikrokristaller baserade på hexapeptider på nanoskala. De krediterade ursprunget till förstyvning till ett ökat innehåll av intermolekylära β-arkstrukturer. Den ökade styvheten i Youngs moduli korrelerade med ökad täthet av intermolekylär vätebindning och parallella β-arkstrukturer för att energiskt stabilisera kristallerna.
Amyloider i materialvetenskap
Amyloider är högordnade strukturer som härrör från proteiner eller peptider och förknippas med en rad sjukdomar inklusive många neurodegenerativa sjukdomar som Alzheimers, Parkinsons, Creutzfeldt-Jakobs sjukdomar, och bovin spongiform encefalopati. Att förstå deras biofysiska egenskaper kan ge massor av ny information för att hämma deras bildning. Inom materialvetenskap, dock, förmågan hos ett stort antal peptider och proteiner att själv sätta ihop till amyloidstrukturer öppnar upp för en metod att använda dem för att utveckla nya nanomaterial för biomedicinska och nanoteknologiska tillämpningar. Som ett resultat, materialforskare är angelägna om att få detaljerad kunskap om strukturen och morfologin hos amyloider i ett bredare sammanhang för tillämpningar över medicin till nanoteknik. I det här arbetet, Adamcik et al. undersökte polymorfismen hos hexapeptidmodellsystemen och använde enkelmolekylkapaciteten hos peakforce kvantitativ nanomekanisk kartläggning av atomkraftsmikroskopi (PF-QNM-AFM) för analysen. Metoden kombinerade AFM (atomic force microscopy) och infraröda tekniker med atommodellering för att studera och korrelera det nanomekaniska, kemiska och strukturella egenskaper hos fibrillen och dess kristallformer i skalan av ett enda aggregat.

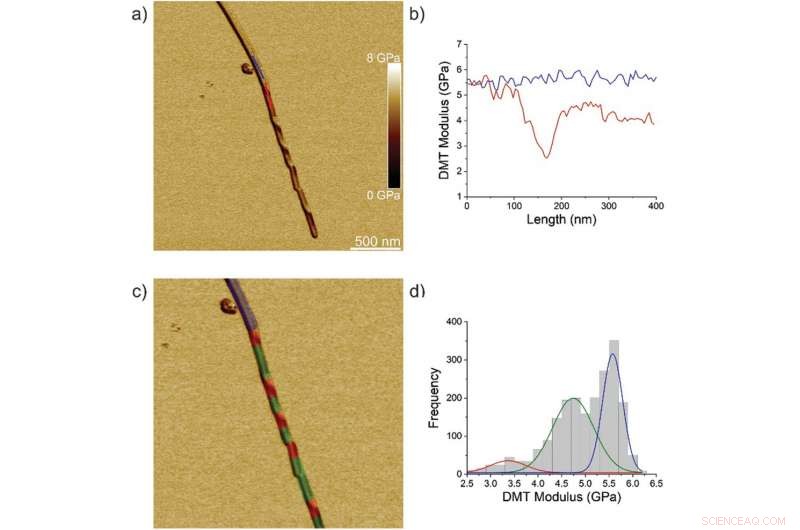
Nanomekaniska egenskaper hos IFQINS fibriller (F), mellanliggande kristaller (IC), och kristaller (C). a) AFM-höjd, b) 3D AFM-höjd, c) AFM-amplitud, och d) AFM DMT-modul för IFQINS-fibriller. e) DMT-modul för IFQINS-fibriller från del (d). f) Histogrammet för DMT-moduler för IFQINS-fibriller. Röd färg motsvarar DMT-modulerna för fibriller, grönt visar mellanliggande kristaller och blått motsvarar DMT-modulerna för kristaller. Kreditera: Avancerad vetenskap , doi:10.1002/advs.202002182
Peak-force kvantitativ nanomekanisk kartläggning av atomkraftsmikroskopi (PF-QNM-AFM)
Teamet analyserade först ILQINS hexapeptider (ett amyloidbildande segment) individuellt för att förstå skillnaden i nanomekaniska och strukturella egenskaper. De extraherade Youngs moduli av cirka 30 olika fibriller med värden (2-3 GPa) typiska för amyloidfibriller. De observerade sedan en annan hexapeptid IFQINS - ett annat amyloidbildande segment, att visa samexistensen av fibriller med en struktur av högerhänta spiralformade band, högerhänta och vänsterhänta vridna band, mellanliggande kristaller och kristaller. I det här fallet, Youngs moduler var olika, och tillät forskarna att särskilja varje strukturell morfologi. Till exempel, fibrillerna som visas i rött hade Youngs modul i intervallet 2-3 GPa ungefär som fibriller som självmonterats från ILQINS. För kristaller avbildade i blått, modulerna låg i intervallet 5-6 GPa, medan mellanliggande kristaller sett i grönt spreds över 2-5 GPa. Dessutom, TFQINS amyloidstrukturer självmonterade till mikrokristaller med ett litet antal tvinnade band, med liknande trender som IFQINS hexapeptider. Teamet erhöll också detaljerad analys av Youngs moduli av en fibril-till-kristall-övergång av TFQINS.
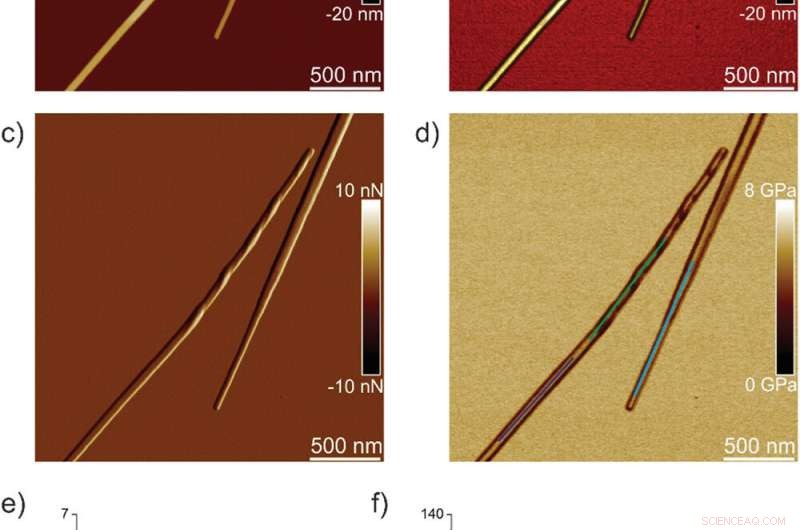
Nanomekaniska egenskaper hos TFQINS-kristaller. a) AFM-höjd, b) 3D AFM-höjd, c) AFM-amplitud, och d) AFM DMT-modul för TFQINS-kristaller. e) DMT-modul för TFQINS-kristaller från del (d). f) Histogrammet för DMT-modulerna för TFQINS-kristaller från del (e). Kreditera: Avancerad vetenskap , doi:10.1002/advs.202002182
Infraröd nanospektroskopi (AFM-IR)
Adamcik et al. tillämpade sedan infraröd (IR) spektroskopi för att ytterligare förstå korrelationen mellan nanomekaniska egenskaper och den kemiska sekundära strukturheterogeniteten hos enstaka fibriller och kristaller. De valde ut IFQINS-peptiderna för experimenten med AFM-IR-verktyget på grund av dess heterogenitet. Forskarna observerade morfologikartor med hjälp av tekniken för att visa samexistensen av vridna fibriller och kristaller på nanoskala. AFM-IR-systemet möjliggjorde den spektroskopiska upplösningen av amidbanden som vanligtvis är kända som fingeravtryck av proteiner eller peptider. Forskarna undersökte de subtila strukturella förändringarna under övergången från den fibrillära till den mellanliggande kristallen till kristalltillståndet, för att indikera en nettoökning av innehållet av intermolekylärt parallellt β-ark och en liten ökning av antiparallell β-arkkonformation. Teamet krediterade resultatet till den ökade Youngs modul från fibrillen till kristalltillstånden, där IR-spektroskopimetoden och AFM-indragning gav en sammanfattning av organisationen i atomskala.
Atomsimuleringar
Forskarna genomförde sedan atomistiska simuleringar av indragningsprocessen för att ytterligare undersöka förändringarna i amyloidmaterialegenskaper efter att ha förvärvat den kristallliknande ordningen. De använde ILQINS-peptider för dessa simuleringar för att förstå versioner av tjocka och tunna amyloidmodeller. Den tunna strukturen hade en mindre kompakt ryggrad jämfört med den tjocka strukturen. Youngs moduli av kristaller överskred de för vridna amyloider med 3,6 GPa för att visa att ordningen av kristaller var större än fibriller, ungefär som med experimentell indragning. Tagen tillsammans, resultaten visade fibril-till-kristall-övergång i amyloid vara associerad med ökad intermolekylär β-skiva och vätebindning som resulterade i förskjutningen av amid I-bandet till lägre vibrationsfrekvenser. Denna förskjutning gjorde det möjligt för kristallstrukturen att bli stabil baserat på vibrationsentropi och långdistansordning av H-bindningar. Arbetet gav en tydlig process av fibril-till-kristall-övergångar för att bilda exceptionellt stabila amyloidliknande kristaller.
Nanomekaniska egenskaper hos TFQINS fibril/kristallövergång. a) AFM DMT-modul för TFQINS-kristall. b) DMT-modul för TFQINS-kristallen från del (a). c) AFM DMT-modul för TFQINS kristall tonad röd, grön eller blå av den tilldelade regionen. d) Histogrammet för DMT-modulerna för TFQINS-kristaller. Röda och gröna färger indikerar vridna eller platta sektioner av fibrill/kristallövergångsregionen, respektive; blått motsvarar kristallområdet. Kreditera: Avancerad vetenskap , doi:10.1002/advs.202002182
Syn
På det här sättet, Jozef Adamcik och kollegor kombinerade en molekylär atomkraftsmikroskopi, nanoindentation och kemisk spektroskopi i nanoskala med atommodellering för att förstå de nanomekaniska och vibrationsegenskaperna hos amyloidpolymorfer. De observerade övergången från fibriller till mikrokristaller och undersökte en serie hexapeptidfragment (inklusive ILQINS, IFQINS, och TFQINS). Amyloidfibrillerna och mikrokristallerna visade olika Youngs moduler, där amyloidkristallerna hade större värden på grund av den högre densiteten och ordningen för intermolekylära β-ark i mikrokristallarkitekturen. Arbetet gav en aldrig tidigare skådad karta över det atomistiska, mesoskopisk, och vibrationsegenskaper hos amyloidaggregatet för att utveckla det molekylära ursprunget för de termodynamiskt stabila amyloidkristallerna för tillämpningar inom materialvetenskap till nanomedicin.
© 2020 Science X Network