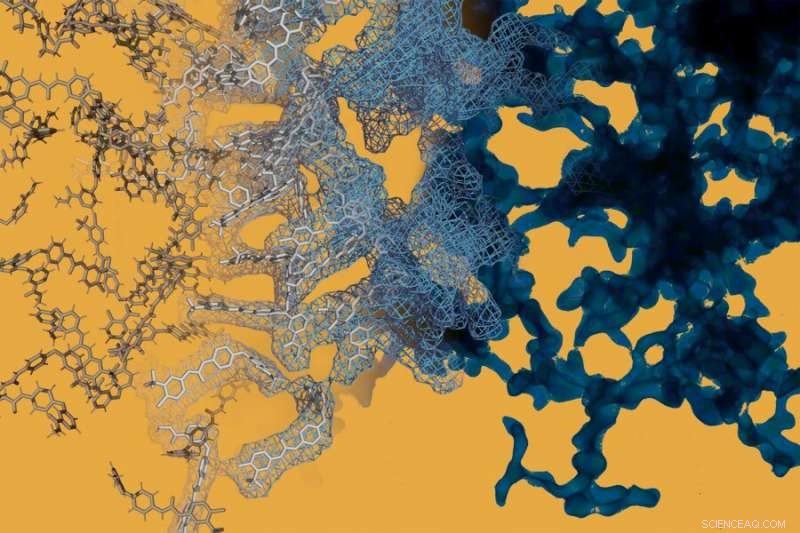
En simulering av molekylär dynamik (vänster) ställs intill en elektronmikroskopibild (höger) av cancerläkemedlet sorafenib. Sorafenib, som många andra småmolekylära läkemedel, kan spontant bilda invecklade strukturer i nanoskala som förändrar hur läkemedlet beter sig. Kredit:Daniel Reker
Läkemedel med små molekyler behandlar en mängd olika sjukdomar, men deras effektivitet är ofta försämrad på grund av deras farmakokinetik – vad kroppen gör med ett läkemedel. Efter administrering, kroppen dikterar hur mycket av läkemedlet som absorberas, vilka organ läkemedlet kommer in i, och hur snabbt kroppen metaboliserar och utsöndrar läkemedlet igen.
Nanopartiklar, vanligtvis gjord av lipider, polymerer, eller båda, kan förbättra farmakokinetiken, men de kan vara komplicerade att producera och innehåller ofta mycket lite av läkemedlet.
Vissa kombinationer av småmolekylära cancerläkemedel och två småmolekylära färgämnen har visat sig självmontera till nanopartiklar med extremt hög nyttolast av läkemedel, men det är svårt att förutsäga vilka småmolekylära partners som kommer att bilda nanopartiklar bland de miljontals möjliga parningar.
MIT-forskare har utvecklat en screeningplattform som kombinerar maskininlärning med experiment med hög genomströmning för att snabbt identifiera självmonterande nanopartiklar. I en studie publicerad i Naturens nanoteknik , forskare undersökte 2,1 miljoner parningar av småmolekylära läkemedel och "inaktiva" läkemedelsingredienser, identifiera 100 nya nanopartiklar med potentiella tillämpningar som inkluderar behandling av cancer, astma, malaria, och virus- och svampinfektioner.
"Vi har tidigare beskrivit några av de negativa och positiva effekter som inaktiva ingredienser kan ha på droger, och här, genom ett samordnat samarbete mellan våra laboratorier och kärnanläggningar, beskriva ett tillvägagångssätt som fokuserar på de potentiella positiva effekter dessa kan ha på nanoformulering, " säger Giovanni Traverso, Karl Van Tassel (1925) Karriärutvecklingsprofessor i maskinteknik, och senior motsvarande författare till studien.
Deras resultat pekar på en strategi för att lösa både komplexiteten i att producera nanopartiklar och svårigheten att ladda stora mängder läkemedel på dem.
"Så många droger där ute lever inte upp till sin fulla potential på grund av otillräcklig inriktning, låg biotillgänglighet, eller snabb läkemedelsmetabolism, säger Daniel Reker, huvudförfattare till studien och en före detta postdoc vid Robert Langers laboratorium. "Genom att arbeta i datavetenskapens gränssnitt, maskininlärning, och läkemedelstillförsel, Vår förhoppning är att snabbt utöka vårt verktygsuppsättning för att se till att ett läkemedel kommer till den plats den behöver vara och faktiskt kan behandla och hjälpa en människa."
Langer, David H. Koch Institute Professor vid MIT och medlem av Koch Institute for Integrative Cancer Research, är också en senior författare av tidningen.
En cancerterapi möter sin match
För att utveckla en maskininlärningsalgoritm som kan identifiera självmonterande nanopartiklar, forskare behövde först bygga en datauppsättning som algoritmen kunde träna på. De valde ut 16 självaggregerande småmolekylära läkemedel med en mängd olika kemiska strukturer och terapeutiska tillämpningar och en mångsidig uppsättning av 90 allmänt tillgängliga föreningar, inklusive ingredienser som redan har lagts till droger för att få dem att smaka bättre, varar längre, eller göra dem mer stabila. Eftersom både läkemedlen och de inaktiva ingredienserna redan är FDA-godkända, de resulterande nanopartiklarna kommer sannolikt att vara säkrare och gå snabbare igenom FDA-godkännandeprocessen.
Teamet testade sedan varje kombination av småmolekylära läkemedel och inaktiv ingrediens, aktiverat av Swanson Biotechnology Center, en svit av kärnanläggningar som tillhandahåller avancerade tekniska tjänster inom Koch Institute. Efter att ha blandat ihop parningar och laddat 384 prover åt gången på nanobrunnsplattor med hjälp av robotik i High Throughput Sciences-kärnan, forskare gick på tallrikarna, ofta med snabbt nedbrytande prover, granne med Peterson (1957) Nanotechnology Materials Core Facility kärna för att mäta storleken på partiklar med hög genomströmning dynamisk ljusspridning.
Nu tränad den 1, 440 datapunkter (med 94 nanopartiklar redan identifierade), maskininlärningsplattformen skulle kunna ställas om på ett mycket större bibliotek av föreningar. Screening av 788 småmolekylära läkemedel mot fler än 2, 600 inaktiva läkemedelsingredienser, plattformen identifierade 38, 464 potentiella självmonterande nanopartiklar från 2,1 miljoner möjliga kombinationer.
Forskarna valde ut sex nanopartiklar för ytterligare validering, inklusive en som består av sorafenib, en behandling som vanligtvis används för avancerad lever- och andra cancerformer, och glycyrrhizin, en förening som ofta används som både livsmedels- och läkemedelstillsats och mest känd som lakritsarom. Även om sorafenib är standardvården för avancerad levercancer, dess effektivitet är begränsad.
I humana levercancercellkulturer, nanopartiklarna sorafenib-glycyrrhizin fungerade dubbelt så bra som sorafenib i sig eftersom mer av läkemedlet kunde komma in i cellerna. Arbeta med den prekliniska modelleringen, Avbildnings- och testanläggning vid Koch Institute, forskare behandlade musmodeller av levercancer för att jämföra effekterna av nanopartiklar av sorafenib-glycyrrhizin jämfört med någon av föreningarna i sig. De fann att nanopartikeln signifikant minskade nivåerna av en markör förknippad med levercancerprogression jämfört med möss som fick sorafenib enbart, och levde längre än möss som fick sorafenib eller glycyrrhizin enbart. Sorafenib-glycyrrhizin nanopartikeln visade också förbättrad inriktning på levern jämfört med oral administrering av sorafenib, den nuvarande standarden på kliniken, eller när du injicerar sorafenib efter att det har kombinerats med cremophor, ett vanligt använt läkemedelsvehikel som förbättrar vattenlösligheten men har toxiska biverkningar.
Personlig läkemedelsleverans
Den nya plattformen kan ha användbara applikationer utöver att optimera effektiviteten hos aktiva läkemedel:den kan användas för att anpassa inaktiva substanser för att passa individuella patienters behov. I tidigare arbeten, medlemmar av teamet fann att inaktiva ingredienser kunde framkalla negativa allergiska reaktioner hos vissa patienter. Nu, med den utökade verktygslådan för maskininlärning, fler alternativ skulle kunna genereras för att tillhandahålla alternativ för dessa patienter.
"Vi har en möjlighet att tänka på att matcha leveranssystemet till patienten, " förklarar Reker, nu biträdande professor i biomedicinsk teknik vid Duke University. "Vi kan redogöra för saker som läkemedelsabsorption, genetik, även allergier för att minska biverkningar vid förlossningen. Oavsett mutation eller medicinskt tillstånd, rätt läkemedel är bara rätt läkemedel om det faktiskt fungerar för patienten."
Verktygen för säker, effektiv läkemedelstillförsel existerar, men att sätta ihop alla ingredienser kan vara en långsam process. Kombinationen av maskininlärning, snabb screening, och förmågan att förutsäga interaktioner mellan olika kombinationer av material kommer att påskynda utformningen av läkemedel och de nanopartiklar som används för att leverera dem i hela kroppen.
I pågående arbete, teamet letar inte bara efter att förbättra effektiv leverans av läkemedel utan också efter möjligheter att skapa mediciner för människor för vilka standardformuleringar inte är ett bra alternativ, använda stora data för att lösa problem i små populationer genom att titta på genetisk historia, allergier, och matreaktioner.
Den här historien återpubliceras med tillstånd av MIT News (web.mit.edu/newsoffice/), en populär webbplats som täcker nyheter om MIT-forskning, innovation och undervisning.