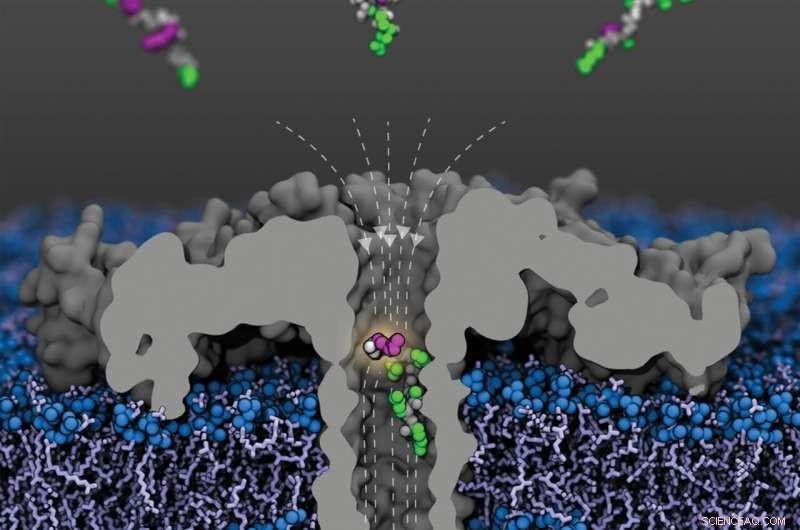
Öppen vy av den modifierade (R220S) aerolysinporen (grå) med fältlinjer (streckade) i ett lipidmembran. Fragment av humant histonprotein 4 acetylerat vid olika lysinrester anländer från den övre avdelningen; ett fragment acetylerat vid lysin-8 visas i poren. Peptidryggraden visas i grått, de omodifierade sidokedjorna i grönt och de acetylerade lysinerna i lila. Kredit:Sarthak Kumar, University of Illinois i Urbana-Champaign
Förändringar som kallas epigenetiska modifieringar spelar en viktig roll i cancerutvecklingen. Att kunna analysera dem snabbt och tillförlitligt skulle kunna bidra väsentligt till vidareutvecklingen av personlig terapi. En forskargrupp från Institutet för fysiologi vid universitetet i Freiburg har nu lyckats karakterisera de kemiska förändringarna i proteiner som är typiska för epigenetiska modifieringar med hjälp av nanoporanalys. Forskarna har publicerat sina forskningsresultat i Journal of the American Chemical Society (JACS ).
De senaste åren har nanoporer blivit ett allmänt användbart verktyg för analys av molekyler. På grund av sina speciella egenskaper tillåter de molekylernas struktur att analyseras inom bråkdelar av en sekund:Som cylindriskt arrangerade proteiner bildar nanoporer små kanaler som bara är några miljondelar av en millimeter (nanometer) i diameter som kan bäddas in i biomembran.
"För experimenten applicerar vi en konstant spänning över membranet så att joner från det omgivande mediet strömmar genom poren. Detta skapar en konstant, exakt mätbar elektrisk ström", förklarar Prof. Dr. Jan C. Behrends från Medicinska fakulteten vid universitetet i Freiburg, i vars laboratorium de nu publicerade experimenten ägde rum. Men när en molekyl migrerar in i poren blockeras strömmen:ju större molekylen är, desto starkare blockeras den också.
Ett protein i forskningens rampljus:H4
Inom ramen för de experiment som nu publicerats ägnade Freiburg-forskarna sig åt undersökningen av det så kallade histonproteinet H4. Detta protein är fast associerat med DNA i alla celler med en kärna och är ett av de bäst undersökta målen för epigenetiska modifieringar. En region vid den N-terminala änden av proteinet påverkas särskilt av dessa modifieringar.
"Proteinsekvensen där innehåller aminosyran lysin flera gånger", förklarar Behrends. Acetyl- eller metylgrupper kan till exempel bindas till dessa lysiner, som betecknas K8, K12 och K16 enligt deras position i proteinkedjan, som en del av epigenetiska modifieringar. Vilken kemisk modifiering som sker vid vilken lysinposition är definitivt av medicinsk betydelse, som Freiburg-fysiologen påpekar. "Acetylering vid K16, till exempel, är viktigt för mänsklig utveckling, medan metylering vid K12 spelar en roll i utvecklingen av vissa prostata- och lungtumörer, enligt de senaste resultaten från Medical Center-University of Freiburg."
Detekterar förändringar med hjälp av en nanopor
I sina experiment kunde Behrends och hans team nu tydligt särskilja H4-fragment med eller utan acetylering, såväl som fragment med en, två eller tre acetyleringar. Dessutom lyckades de visa att nanoporen de använde också var känslig för acetyleringsplatsen:histonfragment med en acetylgrupp vid K8 blockerade ström genom poren starkare än de som acetylerades vid K12, och dessa i sin tur starkare än de med en K16-acetylering.
"Denna typ av känslighet är överraskande eftersom dessa fragment är identiska när det gäller deras massa och totala volym," säger Behrends. Således verkar porströmmen vara känslig inte bara för storleken utan också för formen på molekylen. Det var lika lätt att skilja mellan de olika varianterna av dubbelacetylerade histonfragment — K8 och K12, K8 och K16, och K12 och K16 — igen, trots den identiska massan. H4-fragment metylerade i olika utsträckning och i olika positioner blockerade också strömmen genom porerna i olika grad, men inte lika tydligt som de acetylerade varianterna.
"Vi har kunnat visa för första gången genom våra experiment att nanoporanalys gör att vi kan särskilja molekyler inte bara genom deras storlek, utan också genom deras form", säger studieledaren Behrends. Molekylär dynamiksimuleringar utförda av forskargruppen ledd av Aleksei Aksimentiev från University of Illinois i USA – också involverad i studien – och visar att ett mycket inhomogent elektriskt fält inuti poren spelar en nyckelroll för denna effekt.
Framtidsvision:Optimerad medicinsk diagnostik
Medan sekvenseringen av DNA med nanoporer redan är etablerad och kommersialiserad, har utvecklingen av nanoporbaserad analys av proteiner bara börjat, säger Behrends. "Svårigheten med att sekvensera proteiner är att dessa är molekyler med mycket olikformiga laddningsmönster." Medan DNA, som är negativt laddat, vandrar riktat i det elektriska fältet och därmed kan dras genom porerna bas för bas, består proteiner av byggstenar gjorda av aminosyrorna med olika laddningar. Som ett resultat är riktad rörelse i det elektriska fältet och att "skanna" aminosyra efter aminosyra inte möjligt. Freiburg-forskarna förlitade sig därför på ett annat tillvägagångssätt för sina experiment. Istället för en por med kort sammandragning, som används vid DNA-sekvensering, använde man en skräddarsydd por med en slags molekylär fälla. "Detta gjorde att hela proteinfragmentet kunde fångas på en gång", säger Behrends.
Det är ännu inte klart till vilken fragmentstorlek denna typ av analys kan användas. Ytterligare experiment visar dock att metoden även kommer att vara lämplig för analys av de H4-fragment som tidigare använts i epigenetisk forskning. Dessa innehåller 14 aminosyror istället för de tio som används här, och undersöks för närvarande för epigenetiska modifieringar med tandemmasspektrometri, en mycket utarbetad teknik. Forskarna hoppas att nanoporerna ska göra analysen mycket enklare, snabbare och mer kostnadseffektiv och att den kan utföras nära patienten.
Den fortsatta utvecklingen av nanoporeanalys av proteiner för medicinsk diagnostik och dess implementering i konkreta produkter och tjänster är också ett av de centrala projekten i det nyligen godkända BMBF Cluster4Future nanodiagBW, som Behrends leder tillsammans med Prof. Dr. Felix von Stetten från Hahn- Schickard-Gesellschaft, som är ledande för detta projekt. + Utforska vidare