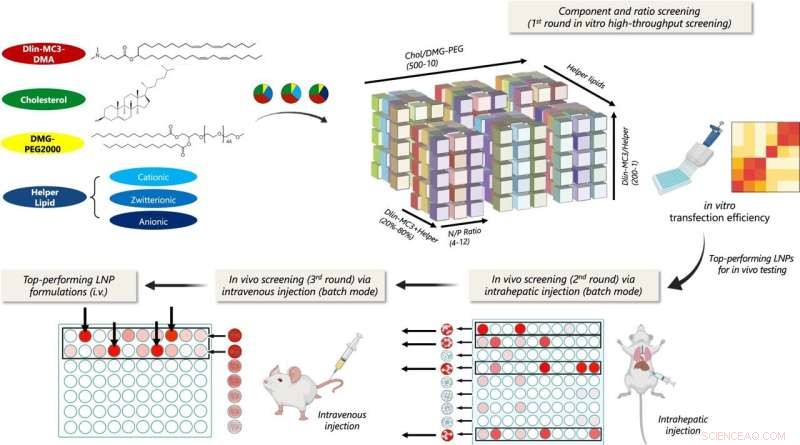
Schematisk illustration av flerstegssammansättningsscreening av lipidnanopartiklar (LNP) för leverinriktad pDNA-leverans. Transfektionseffektivitet in vitro utvärderades för 1080 LNP-formuleringar med olika hjälplipider och komponentförhållanden. De topppresterande formuleringarna för varje hjälparlipidserie testades sedan i kluster för cytotoxicitet och lokal transfektionseffektivitet in vivo via intrahepatisk injektion. Kluster som inducerade minimal cytotoxicitet och hög transfektion screenades via i.v. injektion och LNP-formuleringar inom klustren som visade optimal levertransfektion utvärderades ytterligare individuellt. Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-31993-y
Framgången med covid-19-vacciner är ett bra exempel på genmedicinens enorma potential att förhindra virusinfektioner. En anledning till vaccinernas framgång är deras användning av lipidnanopartiklar, eller LNP, för att transportera känsligt budbärar-RNA till celler för att generera och stärka immunitet. LNPs – små fettpartiklar – har blivit allt populärare som bärare för att leverera olika genbaserade läkemedel till celler, men deras användning är komplicerad eftersom varje LNP måste skräddarsys specifikt för den terapeutiska nyttolasten den bär.
Ett team ledd av Hai-Quan Mao, en materialforskare från Johns Hopkins, har skapat en plattform som visar löfte om att påskynda LNP-designprocessen och göra den mer överkomlig. Det nya tillvägagångssättet kan också anpassas till andra genterapier.
"I ett nötskal, vad vi har gjort är att skapa en metod som screenar lipid nanopartikelkomponenter och deras proportioner för att snabbt hjälpa till att identifiera och skapa den optimala designen för användning med olika terapeutiska gener", säger Mao, chef för Institutet för NanoBioTechnology vid Johns Hopkins Whiting School of Engineering och professor vid institutionerna för materialvetenskap och teknik och biomedicinsk teknik.
Teamets studie publicerades nyligen Nature Communications .
En avgörande egenskap hos effektiva behandlingar är hur länge en genmedicin varar när den når målcellen. Tyvärr börjar styrkan av mRNA att minska inom 24 timmar efter dess leverans av LNP. Ett lovande alternativ är plasmid-DNA – ett kraftigare, dubbelsträngat cirkulärt DNA som kan hålla i upp till sju dagar och därmed har potential att förbättra behandlingsresultaten av metabola sjukdomar och infektioner som påverkar levern, där den terapeutiska varaktigheten är avgörande.
Huvudförfattaren Yining Zhu, en INBT forskare och biomedicinsk ingenjör Ph.D. student, såväl som ett team av forskare från Johns Hopkins och University of Washington, identifierade den bästa LNP-designen för pDNA-leverans till leverceller i detta arbete. Deras plattform screenar LNP:er steg för steg, och tar itu med de fysiologiska hinder som en LNP möter när den navigerar kroppen för att nå sitt mål. Plattformen hjälpte teamet att identifiera de mest effektiva LNP:erna från ett bibliotek med mer än 1 000 kombinationer.
"Denna plattform är mångsidig genom att den inte bara är begränsad till pDNA-leverans, utan lätt kan utökas till utvecklingen av LNP:er för ett brett spektrum av terapeutiska gennyttolaster, såväl som alternativa leveransvägar som oral, intramuskulär injektion eller inhalation metod", sa Zhu.
I samarbete med Sean Murphy, docent vid University of Washington, och hans grupp, utnyttjar forskarna nu LNPs som identifierats med hjälp av plattformen för att utveckla ett malariavaccin som riktar sig mot den sjukdomsframkallande parasiten under dess livscykel i levern. Denna screeningplattform visar ett stort löfte om att hjälpa till att påskynda andra LNP-produktinnovationer för att ytterligare tänja på gränserna för genmedicin, vaccinutveckling och andra nya terapier. + Utforska vidare