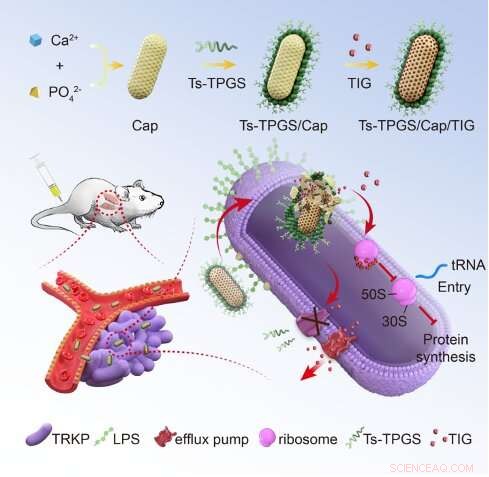
Schematisk skildring av tillverkningen av nanoroderna och mekanismen för att övervinna tigecyklinresistensen hos TRKP. TIG:tigecyklin; Ts-TPGS/Cap/TIG:tigecyklin-laddade TPGS och S-thanatin funktionaliserade kalciumfosfat nanoroder; TRKP:tigecyklinresistent Klebsiella pneumoni. LPS:lipopolysackarid. Kredit:Zhejiang University School of Medicine
Långvarig och överdriven användning av antibiotika har orsakat spridningen av antibiotikaresistens. Den tid- och kostnadskrävande processen för utveckling av nya antibiotika resulterar i att nya antibakteriella läkemedel uppstår mycket långsammare än för bakteriell resistens. Uppkomsten av superbugs har vuxit till att bli en dominerande utmaning för människors hälsa. Tigecyklin anses vara den sista försvarslinjen för att bekämpa multiresistent Klebsiella pneumoniae. Den ökande användningen har dock lett till ökande läkemedelsresistens och behandlingsmisslyckande. Tigecyklinresistens hos Klebsiella pneumoniae är fortfarande ett globalt problem som snabbt måste lösas.
Den 29 juni 2022 sampublicerade Prof. Du Yongzhong från College of Pharmaceutical Sciences, Zhejiang University, Prof. Lu Xiaoyang och Jiang Saiping från The First Affiliated Hospital, Zhejiang University School of Medicine en artikel med titeln "TPGS-based and S- thanatin-funktionaliserade nanorods för att övervinna läkemedelsresistens vid Klebsiella pneumoni" i tidskriften Nature Communications . Deras forskning visar att D-alfa-tokoferylpolyetylenglykolsuccinat (TPGS)-modifierad och S-thanatinpeptid (Ts)-funktionaliserade nanorods baserade på kalciumfosfat-nanopartiklar kan övervinna tigecyklinresistens av Klebsiella lunginflammation.
Först förberedde forskarna de tigecyklinladdade TPGS-modifierade och S-thanatin-peptidfunktionaliserade nanoroderna, Ts-TPGS/Cap/TIG (TTCT), och karakteriserade egenskaperna hos TTCT. De fann att de förberedda Ts-TPGS/Cap nanorodsna effektivt kunde kapsla in TIG och uppnå fördröjd läkemedelsfrisättning. TTCT med en partikelstorlek på ~25 nm skulle inte demonteras i cirkulation och visade utmärkt stabilitet vid rumstemperatur.
Därefter utvärderade forskarna den antibakteriella aktiviteten av TTCT och utforskade de underliggande mekanismerna för att övervinna resistens. De fann att Ts-TPGS/Cap uppvisade målinriktning och ökad ackumulering i både Klebsiella pneumoni (KPN) och TRKP genom bindningen mellan Ts och LPS. TPGS kunde utöva sin hämmande kapacitet på aktiviteten hos effluxpumpar och uttrycket av acrA, acrB och ramA i TRKP. På detta sätt var TIG-koncentrationen inuti bakterier signifikant högre i TTCT-gruppen än andra grupper. Den synergistiska antibakteriella kapaciteten mellan Ts och TIG förstärkte ytterligare den antibakteriella aktiviteten TTCT och övervann därmed läkemedelsresistensen hos TRKP.
Hos möss med lunginflammation ackumulerades Ts-TPGS/Cap specifikt i lungorna. TTCT-administration kan avsevärt minska antalet vita blodkroppar och neutrofiler i blodprover och minska de totala cell- och C-reaktiva proteinnivåerna (CRP) i bronkoalveolär sköljvätska (BALF). Dessutom kunde TTCT förbättra neutrofilinfiltrationen i lungorna och reducera bakteriekolonier från BALF, vilket tydligen ökade överlevnaden för möss med lunginflammation orsakad av TRKP.
Sammantaget utformades ett TPGS-baserat och Ts-modifierat nanoläkemedelsleveranssystem. De preparerade nanoroderna kan förbättra tigecyklinackumuleringen i bakterier via den hämmande effekten på effluxpumpar som utövas av TPGS och målinriktningskapaciteten hos S-thanatin mot bakterier. Den synergistiska antibakteriella kapaciteten mellan S-thanatin och tigecyklin förstärker ytterligare den antibakteriella aktiviteten och övervinner således tigecyklinresistensen hos TRKP. Fynden ger en terapeutisk strategi för infektionssjukdomar orsakade av MDR gramnegativa bakterier. + Utforska vidare