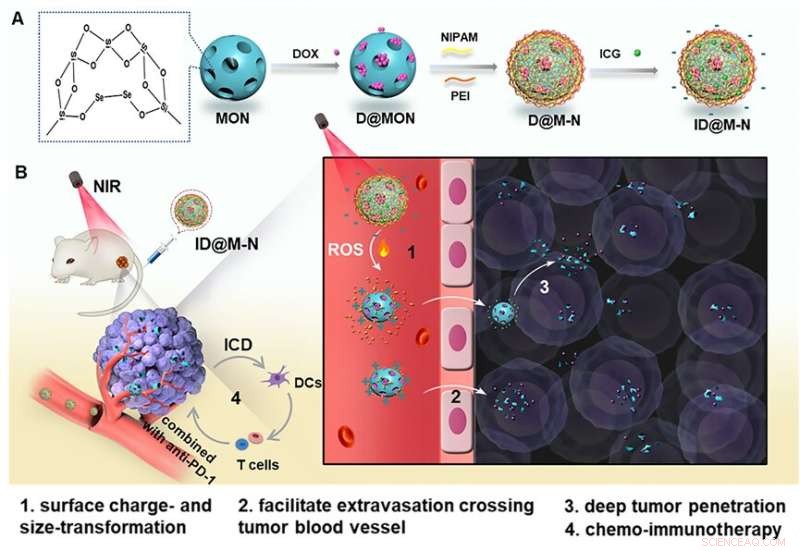
Nanoassemblies (ID@M-N) för NIR-utlöst kemo-immunterapi. Kredit:SIBET
Nyligen samarbetade forskare från Suzhou Institute of Biomedical Engineering and Technology (SIBET) vid den kinesiska vetenskapsakademin och South China University of Technology för att utveckla en nära-infraröd (NIR)-driven nanosammansättning med dubbel transformation av storlek och laddning för kombinationen av fotokontrollerad kemoterapi och immunterapi vid bröstcancer. Resultaten publicerades i Theranostics .
Nanoteknik har unika fördelar när det gäller att förbättra biotillgängligheten för svårlösliga substanser, uppnå kontrollerbar och riktad läkemedelsfrisättning och integrera olika terapeutiska modaliteter på samma plattform. Emellertid möter den olika biologiska barriärer i praktiska tillämpningar, inklusive blodcirkulation, transvaskulär transport, missbildade tumörkärl och tät extracellulär tumörmatris. Som ett resultat är de flesta av nanopartiklarna huvudsakligen lokaliserade runt tumörens perifera, och det är svårt att tränga in i tumören för att utöva en celldödande effekt.
I detta arbete designade forskarna diselenid-bryggade mesoporösa organosilika nanopartiklar som en reaktiv syrespecies (ROS)-känslig kärna för kemoterapeutiska medlet doxorubicin (DOX) laddning. De belade sedan ett indocyaningrönt (ICG)-hybrid-N-isopropylakrylamidskikt för att bilda ett värmekänsligt skal.
"Det negativt laddade värmekänsliga lagret förhindrar DOX-läckage, vilket ger förlängd blodcirkulationstid och hög tumörackumulering", säger Dong Wenfei från SIBET.
Vid NIR-ljusbestrålning underlättar milda fototermiska effekter dissocieringen av det värmekänsliga skalet för att uppnå negativ-till-positiv ytladdningsomkastning. Samtidigt klyver ICG-genererad ROS diselenidbindningen i organosilikakärnan, vilket resulterar i snabb matrisnedbrytning som producerar DOX-innehållande mindre fragment (115 nm till 20 nm).
En sådan NIR-ljusdriven laddning och storlek dubbeltransformerbar nanosammansättning underlättar tumörackumulering och djup penetration, förbättrar kemoterapieffektiviteten och inducerar kraftfulla immunogena celldödseffekter in vitro och in vivo.
I djurstudier, kombinerat med programmerad celldöd protein-1 checkpoint blockad, blockerade nanosystemet signifikant primär tumörtillväxt och lungmetastaser av bröstcancer, vilket kraftigt minskade de toxiska biverkningarna av fria läkemedel.
Denna studie ger en ny plattform för säker och effektiv kombinationsterapi för bröstcancer. Forskargruppen kommer att modifiera antikropparna på ytan av nanosammansättningen för att förbättra den aktiva inriktningen av tumörer och försöka använda systemet för att bära genredigeringsverktyg för genterapi av tumörer. + Utforska vidare