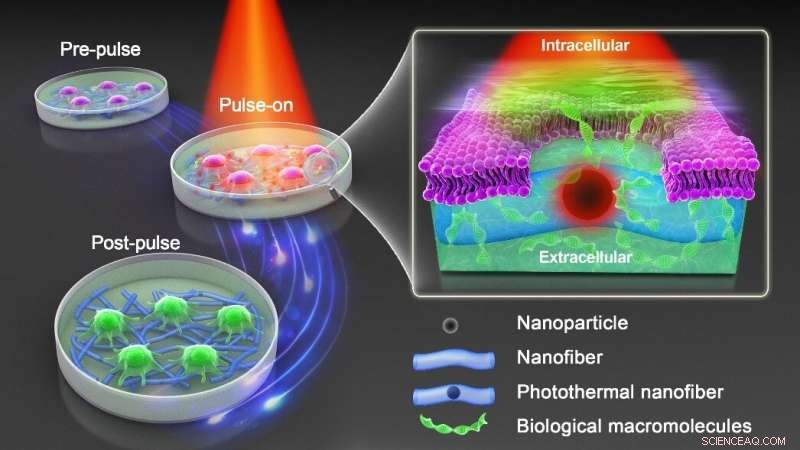
Grafiskt abstrakt. Kredit:DOI:10.1038/s41565-021-00976-3
Professor Kevin Braeckmans från Gents universitet fokuserade de senaste 10 åren på en metod för säker konstruktion av terapeutiska celler med fototermiska nanofibrer. Idag är Nanoteknologi ger insikt i hur dessa biokompatibla fototermiska nanofibrer utvecklades, och hur, vid laserbestrålning, celler som kommer i kontakt med dessa nanofibrer blir permeabiliserade och kan transfekteras med en mängd olika effektormolekyler, inklusive CRISPR/Cas9 ribonukleoproteinkomplex och siRNA. Professor Braeckmans och hans team visade att celler, såsom embryonala stamceller och mänskliga T-celler, transfekterade med sådana nanofibrer är vid utmärkt hälsa och behåller sin terapeutiska funktionalitet.
Ny grund för cellbaserade terapier
Cellbaserade terapier utgör en nyare behandlingsform där genetiskt modifierade celler injiceras i patienten för att förebygga eller behandla sjukdomar. Ett välkänt exempel är användningen av en cancerpatients egna immunceller som kan isoleras, genetiskt modifieras och expanderas i en labbmiljö och återinfunderas i patienten för att attackera tumörcellerna. Genetisk modifiering av celler är beroende av intracellulära leveransteknologier som ofta kämpar med att uppnå tillräcklig effektivitet samtidigt som de har minimal inverkan på cellens hälsa och funktion.
Nanopartikel-sensibiliserad fotoporering är särskilt lovande i detta avseende eftersom det vanligtvis ger hög effektivitet, hög genomströmning och låg toxicitet. Den är baserad på användningen av ljuskänsliga nanopartiklar, såsom guldnanopartiklar (NP), som kan bilda explosiva nanobubblor vid pulserande laserbestrålning. Dessa små explosioner kan inducera små porer i cellmembranen, vilket gör att externa effektormolekyler kompletterade i cellmediet kan komma in i cellerna. Översättning av nanopartikelsensibiliserad fotoporation till kliniska tillämpningar hindras dock av det faktum att celler har varit i kontakt med (icke-nedbrytbara) nanopartiklar, vilket utgör toxikologiska och regulatoriska problem.
Därför behövs ett nytt tillvägagångssätt som behåller fördelen med nanopartikelsensibiliserad fotoporering samtidigt som man undviker direktkontakt av nanopartiklar och celler. Som visas i figuren ovan bäddade professor Braeckmans och hans team in fototermiska järnoxidnanopartiklar (IONPs) i biokompatibla polymera nanofibrer som producerades genom elektrospinning. Polykaprolakton (PCL) är en biokompatibel polymer som ofta används i biomedicinska tillämpningar, medan IONP är kostnadseffektiva och har ett brett ljusabsorptionsspektrum.
De visar att både vidhäftande celler och suspensionsceller kan transfekteras säkert och effektivt med en rad makromolekyler vid bestrålning med nanosekundlaserpulser. Genom att utföra elementaranalys via induktivt kopplad plasma-tandem masspektrometri (ICP-MS/MS), bekräftar de att IONP förblir säkert inbäddade i nanofibrerna efter laserbestrålning så att de behandlade cellerna effektivt är fria från direkt exponering för nanopartiklar. Numeriska simuleringar av värmeöverföring från fiberinbäddade IONP:er till närliggande celler utfördes för att bättre förstå hur laserpulsfluensen, IONP-fördelningen och aggregeringstillståndet påverkar cellmembranets permeabilitet.
Experimentellt visade teamet att fotoporering med fototermiska nanofibrer framgångsrikt kunde leverera funktionella biologiska molekyler, inklusive siRNA eller CRISP-Cas9 ribonukleoproteiner (RNP), till både vidhäftande och suspensionsceller, inklusive mänskliga embryonala stamceller (hESC) och primära mänskliga T-celler. Som ett riktmärke gjordes en jämförelse med den senaste elektroporeringen. Även om elektroporerade celler led av förändringar i deras fenotyp och funktionalitet, var detta inte fallet för fotoporerade celler som behöll sin förmåga att föröka sig och, i fallet med CAR-T-celler, att döda tumörceller. Slutligen användes PEN-fotoporering för att transfektera CAR-T-celler med siRNA som riktade sig mot PD1-receptorn, en välkänd immunkontrollpunktshämmare. siPD1-behandlade celler bekräftades ha förbättrad tumördödande kapacitet in vivo.
Tillsammans visar det att fotoporering med fototermiska nanofibrer möjliggör effektiv och säker intracellulär leverans av ett brett utbud av effektormolekyler i en mängd olika celltyper utan kontakt med potentiellt toxiska fototermiska nanopartiklar. "Vi tror att detta är ett viktigt steg mot användningen av fotoporation för säker och effektiv produktion av genmodifierade cellterapier", säger professor Braeckmans. + Utforska vidare