Terapeutiska cancervacciner är en form av immunterapi i vardande som inte bara kan förstöra cancerceller hos patienter, utan även förhindra att en cancer kommer tillbaka och sprider sig. Flera terapeutiska cancervacciner studeras i kliniska prövningar, men trots deras löfte används de ännu inte rutinmässigt av kliniska onkologer för att behandla sina patienter.
Den centrala ingrediensen i terapeutiska cancervacciner är antigener, som företrädesvis produceras eller nyproduceras (neoantigener) av tumörceller och gör det möjligt för en patients immunsystem att söka och förstöra cancercellerna.
I de flesta fall kan dessa antigener inte agera ensamma och behöver hjälp av adjuvansmolekyler som utlöser en allmän larmsignal i immunceller som kallas antigenpresenterande celler (APC). APC:er internaliserar både antigen- och adjuvansmolekyler och presenterar antigenerna för olika typer av T-celler. Dessa T-celler ger sedan en omedelbar attack mot tumören, eller bevarar ett längre varaktigt minne av tumören för framtida försvar.
Ett cancervaccins effektivitet beror på nivån och varaktigheten av det "larm" som dess adjuvans kan ringa i APC. Tidigare har forskare funnit att leverans av adjuvans- och antigenmolekyler till APC:er samtidigt med nanostrukturer som DNA-origami kan öka APC-aktiveringen. Ingen av dessa tillvägagångssätt undersökte dock systematiskt hur antalet och arrangemanget i nanoskala av adjuvansmolekyler påverkar nedströms tumörriktad immunitet.
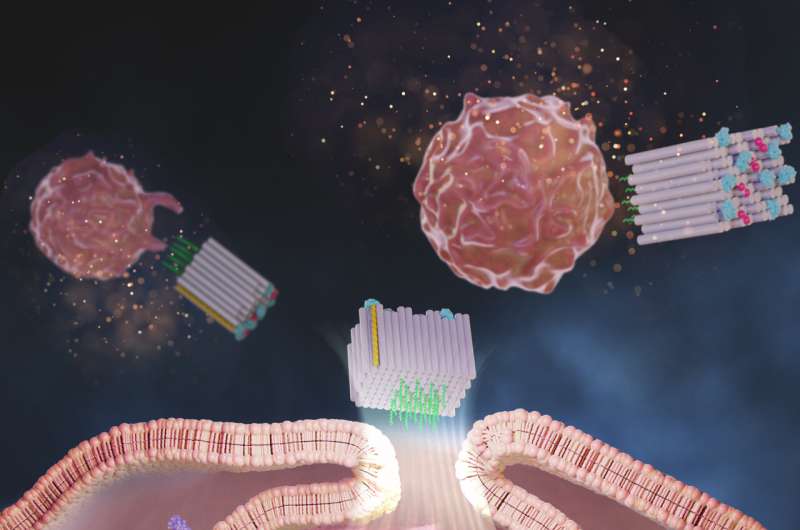
Nu har ett forskarlag vid Wyss Institute vid Harvard University, Dana-Farber Cancer Institute (DFCI), Harvard Medical School (HMS) och Korea Institute of Science and Technology (KIST) skapat en DNA-origamiplattform kallad DoriVac, vars kärna komponenten är en självmonterande kvadratisk blockformad nanostruktur.
Till ena sidan av det kvadratiska blocket kan definierade antal adjuvansmolekyler fästas i mycket avstämbara, nanoprecisa mönster, medan den motsatta sidan kan binda tumörantigener. Studien fann att molekyler av ett adjuvans som kallas CpG placerade exakt 3,5 nanometer från varandra resulterade i den mest fördelaktiga stimuleringen av APC som inducerade en mycket önskvärd profil av T-celler, inklusive de som dödar cancerceller (cytotoxiska T-celler), de som orsakar fördelaktig inflammation (Th-1-polariserade T-celler), och de som ger ett långsiktigt immunminne av tumören (minnes-T-celler).
DoriVac-vacciner gjorde det möjligt för tumörbärande möss att bättre kontrollera tillväxten av tumörer och att överleva betydligt längre än kontrollmöss. Viktigt är att effekterna av DoriVac också synergiserade med effekterna av immunkontrollpunktshämmare, som är en mycket framgångsrik immunterapi som redan används flitigt på kliniken. Resultaten publiceras i Nature Nanotechnology .
"DoriVacs DNA-origamivaccinteknologi förenar olika nanoteknologiska förmågor som vi har utvecklat under åren med en ständigt djupare kunskap om cancerhämmande immunprocesser", säger Wyss Core Faculty-medlem William Shih, Ph.D., som ledde Wyss Institute-teamet tillsammans med förstaförfattaren Yang (Claire) Zeng, M.D., Ph.D..
"Vi föreställer oss att antigener som identifieras hos patienter med olika typer av tumörer i framtiden snabbt kan laddas på prefabricerad, adjuvansinnehållande DNA-origami för att möjliggöra högeffektiva personliga cancervacciner som kan paras med FDA-godkända checkpoint-hämmare i kombinationsterapier. "
Shih är också professor vid HMS och DFCI:s avdelning för cancerbiologi och, som några av de andra författarna, medlem av det tvärinstitutionella centret "Immuno-engineering to Improve Immunotherapy" (i3) baserat på Wyss.
CpG-adjuvansen är en syntetisk DNA-sträng som består av upprepade CpG-nukleotidmotiv som efterliknar det genetiska materialet från immuncellinvaderande bakteriella och virala patogener. Liksom sina naturliga motsvarigheter binder CpG-adjuvans till en "faroreceptor" som kallas TLR9 i immunceller, vilket i sin tur inducerar ett inflammatoriskt (medfödd) immunsvar som samverkar med det antigeninducerade (adaptiva) immunsvaret.
"Vi visste från tidigare arbete att för att utlösa starka inflammatoriska svar, måste TLR9-receptorer dimerisera och aggregera till multimera komplex som binder till flera CpG-molekyler. Nanoskala avstånden mellan de CpG-bindande domänerna i effektiva TLR9-sammansättningar som avslöjades genom strukturanalys föll rakt in i intervallet av vad vi antog att vi kunde spegla med DNA-origamistrukturer som presenterar exakt åtskilda CpG-molekyler," förklarade Zeng, som var instruktör i medicin vid tidpunkten för studien och nu är senior forskare vid DFCI och Harvard Medical School (HMS).
Förutom Shih blev Zeng också mentor i projektet av seniorförfattarna Ju Hee Ryu, Ph.D., en huvudforskare vid KIST, och Wyss Founding Core Faculty-medlem David Mooney, Ph.D., som också är professor vid Harvard John A. Paulson School of Engineering and Applied Sciences (SEAS) och en av i3 Centers huvudutredare.
Zeng och teamet tillverkade DoriVac-vacciner där olika antal CpG-strängar var åtskilda på 2,5, 3,5, 5 eller 7 nanometer från varandra på ena sidan av det kvadratiska blocket, och en modellantigen fästes på den motsatta sidan. De skyddade sina strukturer från att förstöras i kroppen med en kemisk modifieringsmetod som Shihs grupp hade utvecklat tidigare.
När de internaliserades av olika typer av APC, inklusive dendritiska celler (DC), som orkestrerar tumörriktade T-cellssvar, förbättrade DoriVac-vaccinerna upptaget av antigener jämfört med kontroller som består av fria antigenmolekyler.
Ett CpG-avstånd på 3,5 nanometer gav de starkaste och mest fördelaktiga svaren i APC:er och överträffade betydligt ett kontrollvaccin som endast innehöll fria CpG-molekyler.
"Vi var glada över att finna att DoriVac-vaccinet företrädesvis inducerade ett immunaktiveringstillstånd som stöder antitumörimmunitet, vilket är vad forskare i allmänhet vill se i ett bra vaccin", säger Zeng.
Förutom avstånd spelade även antalet CpG-molekyler i DoriVac-vacciner roll. Teamet testade vacciner som innehöll mellan 12 till 63 optimalt åtskilda CpG-molekyler och fann att 18 CpG-molekyler gav den bästa APC-aktiveringen. Detta innebar att deras tillvägagångssätt också kan hjälpa till att begränsa dosen av CpG-molekyler och därmed minimera vanliga toxiska biverkningar som observeras med adjuvans.
Viktigt är att dessa in vitro-trender översattes till in vivo-mustumörmodeller. När de injiceras profylaktiskt under huden på möss, samlades DoriVac-vacciner i de närmaste lymfkörtlarna där de stimulerade DCs.
Ett vaccin laddat med ett melanomantigen förhindrade tillväxten av efterföljande injicerade aggressiva melanomceller. Medan alla kontrolldjur hade dukat under för cancern på dag 42 av experimentet, levde alla DoriVac-skyddade djur.
DoriVac-vacciner hämmade också tumörtillväxt hos möss där bildandet av melanomtumörer redan var på gång, med ett 3,5 nanometers avstånd på 18 CpG-molekyler som återigen gav maximala effekter på DC- och T-celler, och den starkaste minskningen av tumörtillväxt.
Därefter frågade teamet om DoriVac-vacciner också kunde stärka immunsvar som produceras av små "neoantigener" som dyker upp i melanomtumörer.
Neoantigener är idealiska mål eftersom de uteslutande tillverkas av tumörceller. Emellertid är de ofta inte särskilt immunogena själva, vilket gör högeffektiva adjuvans till en viktig komponent i neoantigenvacciner. Ett DoriVac-vaccin anpassat med fyra neoantigener gjorde det möjligt för forskarna att avsevärt undertrycka tillväxten av tumören hos möss som producerade neoantigener.
Slutligen frågade forskarna om DoriVac kunde synergisera med immunkontrollpunktsterapi, som återaktiverar T-celler som har tystats i tumörer.
Hos möss resulterade de två terapierna i kombination i en total regression av melanomtumörer och förhindrade dem från att växa tillbaka när djuren exponerades för samma tumörceller igen fyra månader senare. Djuren hade byggt upp ett immunminne av tumören. Teamet erhöll en liknande vaccinationseffektivitet i en muslymfommodell.
"Vi tror att DoriVacs värde för att bestämma en sweet spot i adjuvanttillförsel och förbättra leveransen och effekterna av kopplade antigener kan bana väg för effektivare kliniska cancervacciner för användning hos patienter med en mängd olika cancerformer", säger Zeng.
Teamet översätter för närvarande DoriVac-plattformen mot dess kliniska tillämpning, vilket stöds av studiens bedömning av vaccindistribution och vaccinriktade antikroppar i möss, såväl som cytokiner som produceras av immunceller som svar på vaccinerna in vivo.
"DoriVac-plattformen är vårt första exempel på hur vår strävan efter vad vi kallar Molecular Robotics - syntetiska bioinspirerade molekyler som har programmerbar form och funktion - kan leda till helt nya och kraftfulla terapier. Denna teknologi öppnar en helt ny väg för utveckling av designvacciner med egenskaper som är skräddarsydda för att möta specifika kliniska utmaningar. Vi hoppas kunna se dess snabba översättning till kliniken, säger Wyss Institutes grundare Donald Ingber, M.D., Ph.D.
Mer information: Yang C. Zeng et al, Finjustering av rumslig CpG-fördelning med DNA-origami för förbättrad cancervaccination, Nature Nanotechnology (2024). DOI:10.1038/s41565-024-01615-3
Tillhandahålls av Harvard University