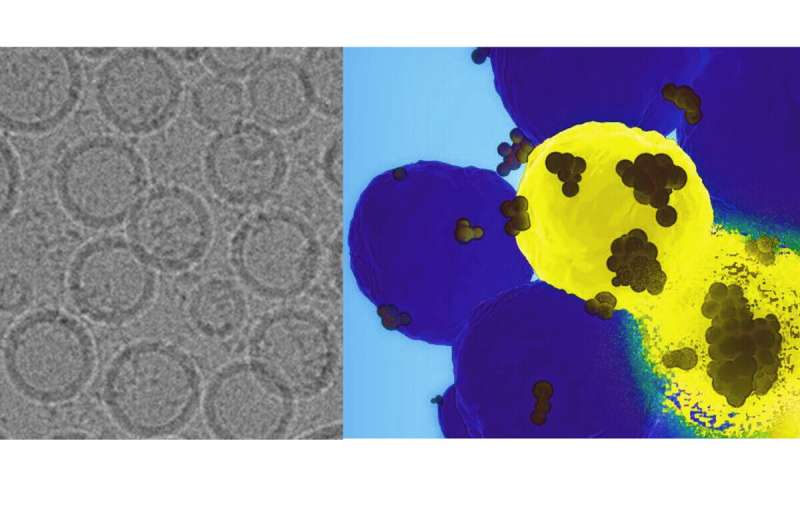
En nyutvecklad "GPS-nanopartikel" som injiceras intravenöst kan komma in på cancerceller för att ge ett genetiskt slag till proteinet som är inblandat i tumörtillväxt och spridning, enligt forskare från Penn State. De testade sitt tillvägagångssätt i mänskliga cellinjer och i möss för att effektivt slå ner en cancerframkallande gen, och rapporterade att tekniken potentiellt kan erbjuda en mer exakt och effektiv behandling för notoriskt svårbehandlade basalliknande bröstcancer.
De publicerade sitt arbete i ACS Nano . De lämnade också in en provisorisk ansökan om patent på tekniken som beskrivs i studien.
"Vi utvecklade en GPS-nanopartikel som kan hitta platsen där den behövs", säger motsvarande författare Dipanjan Pan, Dorothy Foehr Huck &J. Lloyd Huck ordförande professor i nanomedicin och professor i kärnteknik och i materialvetenskap och ingenjörsteknik vid Penn State .
"Väl där - och bara där - kan den leverera genredigeringsproteiner för att förhindra att cancercellerna sprids. Det var en svår uppgift, men vi visade att systemet fungerar för basalliknande bröstcancer."
I likhet med trippelnegativa bröstcancer kan basalliknande bröstcancer vara mindre vanliga än andra bröstcancerformer, men de kan vara mycket mer utmanande att behandla, till stor del för att de saknar de tre terapeutiska målen som finns i andra bröstcancerformer. De tenderar också att vara aggressiva, snabbt växande tumörer och fälla celler som sprider sig någon annanstans i kroppen. Dessa celler kan så ytterligare tumörer, en process som kallas metastaser.
"Metastasering är en stor utmaning, särskilt med cancer som trippelnegativa och basalliknande bröstcancer," sade Pan. "Cancern kan vara svår att upptäcka och dyker inte upp under en rutinmässig mammografi, och den drabbar främst den yngre eller afroamerikanska befolkningen som kanske inte får förebyggande vård ännu. Resultatet kan bli väldigt, väldigt dåligt, så det är tydligt. otillfredsställt kliniskt behov av effektivare behandlingar när cancern inte upptäcks tidigt nog."
Teamet tillverkade en nanopartikel från trojansk häst, som maskerade den med specialdesignade fettmolekyler som ser ut som naturligt förekommande lipider och packade den full av CRISPR-Cas9-molekyler. Dessa molekyler kan rikta in sig på det genetiska materialet i en cell, identifiera en viss gen och slå ner den eller göra den ineffektiv. I det här fallet riktade systemet sig mot mänsklig gaffelbox c1 (FOXC1), som är inblandad i att anstifta metastaser.
Pan beskrev designerlipiderna som "zwitterjoniska", vilket betyder att de har nästan neutral laddning på nanopartikelns skal. Detta förhindrar kroppens immunsystem från att attackera nanopartikeln – eftersom den är förklädd som en icke-hotande, normal molekyl – och kan hjälpa till att frigöra nyttolasten, men bara när lipiderna känner igen cancercellens låga pH-miljö.
För att säkerställa att lipiderna bara skulle aktiveras vid det låga pH, designade forskarna dem att flytta sina laddningar till positiva när de väl kommer in i den surare tumörmikromiljön, vilket utlöser nyttolasten.
Men kroppen är en stor plats, så hur kunde forskarna säkerställa att CRISPR-Cas9-nyttolasten nådde rätt mål? För att säkerställa att nanopartikeln skulle binda till rätt celler fäste de en epitelcelladhesionsmolekyl (EpCAM), som är känd för att fästa till basalliknande bröstcancerceller.
"Ingen har någonsin försökt att rikta in sig på en basalliknande bröstliknande cancercell med ett kontextresponsivt leveranssystem som genetiskt kan slå ner genen av intresse," sa Pan. "Vi är de första som visar att det kan göras."
Andra har utvecklat virala leveranssystem, kapat en viruspartikel för att bära behandling till cellerna, och icke-virala leveranssystem som använder nanopartiklar. Skillnaden, sade Pan, för hans teams tillvägagångssätt är ytlipiden som är utformad för att endast svara i målmiljön, vilket minskar risken för leverans utanför målet och skada på friska celler.
Dessutom, tillade han, eftersom kroppen inte anser att lipiderna är ett hot, finns det mindre chans för ett immunsvar, vilket de validerade i sina experiment.
Teamet testade först metoden i mänskliga trippelnegativa bröstcancerceller, och validerade att nanopartikeln skulle distribuera CRISPR/Cas9-systemet i rätt miljö. De bekräftade att nanopartikeln kunde hitta sin väg till en tumör i en musmodell, distribuera systemet och framgångsrikt slå ner FOXC1.
Därefter, sade Pan, planerar forskarna att fortsätta testa nanopartikelplattformen med det slutliga målet att tillämpa den kliniskt på människor.
"Vi undersöker också hur vi annars kan tillämpa plattformstekniken," sa Pan. "Vi kan anpassa molekylerna på ytan, nyttolasten den bär och använda den för att uppmuntra läkning i andra områden. Det finns mycket potential med den här plattformen."
Mer information: Parikshit Moitra et al, Context-Responsive Nanopartikel härledd från syntetiska Zwitterioniska joniserbara fosfolipider i målinriktad CRISPR/Cas9-terapi för basalliknande bröstcancer, ACS Nano (2024). DOI:10.1021/acsnano.4c01400
Tillhandahålls av Pennsylvania State University