I en studie som nyligen publicerats i tidskriften Small , forskare från Nano Life Science Institute (WPI NanoLSI), Kanazawa University, Japan, som samarbetar med professor Sarikaya, Seattle, USA, använde frekvensmodulerad atomkraftsmikroskopi för att avslöja den molekylära arkitekturen hos genetiskt designade och punktmuterade peptider och deras självorganisationer var och en bildar enmolekylära tjocka, distinkta biologiska kristaller på atomärt platt grafit och MoS2 ytor, som erbjuder en potentiell plattform för hybridteknologier som bioelektronik, biosensorer och proteinmatriser.
Proteiner är de viktigaste molekylära byggstenarna inom biologin, som utför enzymatiska funktioner, transporterar joner och elektroner och utgör den huvudsakliga infrastrukturen för cellulära arkitekturer, såsom jonpumpar. Funktionerna hos proteiner beror på deras aminosyrasekvenser, som i sin tur dikterar deras tredimensionella molekylära strukturer.
Proteiners aminosyrasekvenser kodas av generna (DNA-kod) från en given specialiserad cell. Varje defekt i aminosyrasekvensen, såsom en punktmutation, en förändring i platsen för en aminosyra, en saknad aminosyra eller transpositionen av två eller flera aminosyror, förväntas därför påverka proteinets molekylstruktur , vilket återspeglas i deras funktion, vilket ofta leder till genetiska sjukdomar.
I likhet med proteiner är peptider också sammansatta av aminosyraenheter, och varje peptid har en unik sekvens; dock är de mycket kortare, från 10 till 30 enheter, och kodas på liknande sätt av DNA. De är lättare att manipulera, designa och använda jämfört med proteiner, som är mycket större (hundratals eller tusentals aminosyror långa), svåra att syntetisera och opraktiska att använda.
Därför är det absolut nödvändigt att om framtidens praktiska teknik ska utvecklas baserat på lärdomar från biologi i molekylär skala, måste den grundläggande vetenskapen etableras med hjälp av peptider, som sedan kan implementeras i verkliga tillämpningar, såsom biosensorer , bioelektronik och logiska enheter, såväl som droger, allt baserat på lärdomar från biologi.
Professor Sarikaya insåg denna utgångspunkt och initierade en ny konvergensvetenskaplig strategi för två decennier sedan, som involverade genteknik, molekylärbiologi, informatik, maskininlärning och materialvetenskap och ingenjörskonst, vid design av fasta bindande peptider, och visade deras användning i praktiska hybridteknologier.
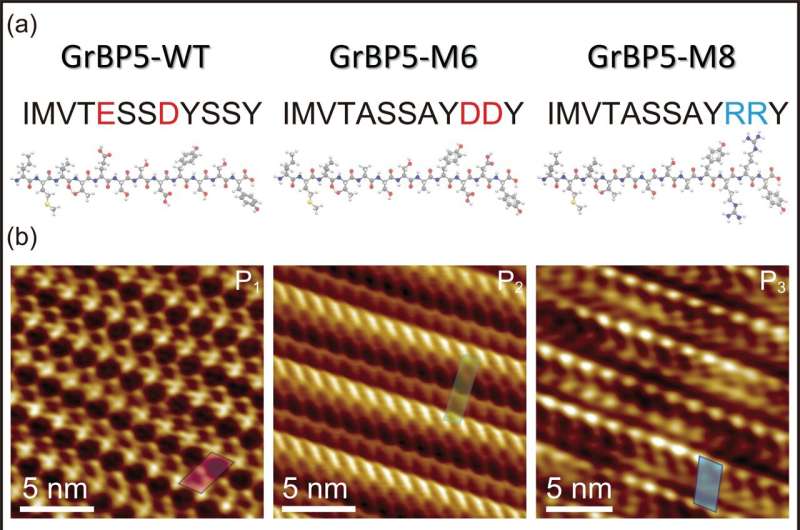
I denna nya studie muteras en av dessa peptider, specifikt utformad som en grafitbindande peptid, till två olika peptider, M6 och M8, var och en nominellt samma molekylvikt och storlek men innehåller punktmutationer av de laddade aminosyrorna, en negativ respektive den andra positiva.
Som förutspåtts skulle de fungera annorlunda, vilket de gjorde. Frågan som var omöjlig att förutsäga på förhand var hur exakt de skulle agera annorlunda från varandra och vildtypen (den ursprungliga) peptiden, och vad skulle vara detaljerna i deras molekylära struktur och deras kinetiska beteende på ytan av peptiden. substratgrafit.
Svaren på dessa frågor, vars avsaknad hittills begränsat förståelsen av förhållandet mellan mutanter och deras förutsägbara beteende, krävde mycket hög upplösning och direkt avbildning av molekylerna vid deras ursprungliga tillstånd, i vatten under en period av sekunder till timmar.
Det är här som professor Takeshi Fukumas laboratorium kommer in i bilden vid WPI Nano Life Science Institute, Kanazawa University, där hans team har utvecklat anläggningar för Frequency-Modulated Atomic Force Microscopy som kan förhöra objekt i molekylär skala med nära ångströms bildupplösning och för långa tidsperioder i vattenhaltiga miljöer – en ovanlig kombination av kapacitet för ett experimentellt system, särskilt för biologisk forskning.
Med forskarnas mycket skickliga experimentella förmågor (med outtömligt tålamod i långvariga tester), ledda av Dr. Ayhan Yurtsever, Dr. Kaito Hirata, Dr. Linhao Sun och Dr. Takeshi Fukuma, upptäckte teamet beteendet hos mutanter i oöverträffad detalj, ger resultat med betydelse som korsar flera traditionellt olika discipliner, från materialvetenskap till fysik, till kemi och biologi.
För det första, trots mutationerna och individuellt med en annan övergripande laddning, band varje peptid inte bara till grafitytan utan sattes också ihop och bildade enmolekyltjocka peptidkristaller. Men medan den första mutanten, den negativt laddade, bildade ett kristallint snett gitter med två molekyler (lindade runt varandra) i varje gitter, bildade den andra mutanten, den positivt laddade, ett annat snett gitter innehållande en enda peptid.
Vad som verkligen är värdefullt här är att beteendet hos peptiderna är enkelt och direkt relaterat till deras molekylära arkitektur, modellerad med hjälp av molekylär dynamik. Forskarna kunde därför matematiskt beskriva förhållandet mellan var och en av peptiderna (var och en bildar olika sneda molekylära gitter) och det hexagonala gittret hos grafitsubstratet, vilket uteslutande beskrivs som kiral igenkänning.
I själva verket innebär detta att varje peptid har visat sig bilda ett hybridgränssnitt med substratgrafiten, bäst beskrivet som kristallografiskt koherent utan något märkbart gap däremellan, inte olikt ligand-receptor eller protein/DNA-interaktioner inom biologi.
Varken den molekylära igenkänningen av fasta tillståndsobjekt av en "levande" molekyl har observerats så tydligt tidigare, inte heller har dess detaljer beskrivits som kirala, vilket båda bidrar till betydelsen av resultaten som presenteras i denna publikation.
Å ena sidan, ur det biologiska perspektivet, finns det nu gott om data och detaljer om hur mutationer leder till molekylära konformationsförändringar och den resulterande funktionen hos peptiderna, som kan expanderas till proteiners beteende, med betydelse för genetiska mutationer och effektiv läkemedelsdesign.
Och å andra sidan tyder koherent hybridisering på att animerade och livlösa objekt i nanoskala är stabilt närvarande vid samma mjuka gränssnitt och bildar en exklusiv molekylär bro som bäst skulle kunna beskrivas genom att sömlöst integrera biologi med enheter i fast tillstånd.
Om så är fallet, baserat på denna studie, förväntas forskare och teknologer enormt bredda repertoaren av den molekylära basen för framtida bio/nano-enheter genom att använda det enkla molekylärbiologiska mutationsverktyget.
Mer information: Ayhan Yurtsever et al, Dynamics of Molecular Self-Assembly of Short Peptides at Liquid-Solid Interfaces—Effect of Charged Amino Acid Point Mutations, Small (2024). DOI:10.1002/smll.202400653
Journalinformation: Liten
Tillhandahålls av Kanazawa University