Vissa covid-19-vacciner använde säkert och effektivt lipidnanopartiklar (LNP) för att leverera budbärar-RNA till celler. En ny MIT-studie visar att olika nanopartiklar kan användas för en potentiell behandling av Alzheimers sjukdom (AD). I tester i flera musmodeller och med odlade mänskliga celler levererade en nyligen skräddarsydd LNP-formulering effektivt litet störande RNA (siRNA) till hjärnans mikroglia-immunceller för att undertrycka uttrycket av ett protein kopplat till överdriven inflammation vid Alzheimers sjukdom.
I en tidigare studie visade forskarna att blockering av konsekvenserna av PU.1-proteinaktivitet hjälper till att minska Alzheimers sjukdomsrelaterad neuroinflammation och patologi. De nya resultaten, rapporterade i tidskriften Advanced Materials , uppnå en minskning av inflammation genom att direkt dämpa uttrycket av Spi1-genen som kodar för PU.1.
Mer generellt visar den nya studien också ett nytt sätt att leverera RNA till mikroglia, som hittills varit svåra att rikta in sig på.
Studiens co-senior författare Li-Huei Tsai, Picower professor i neurovetenskap och chef för Picower Institute for Learning and Memory and Aging Brain Initiative, sa att hon antog att LNP:er kan fungera som ett sätt att föra in siRNA i mikroglia eftersom cellerna, som renar avfall i hjärnan, har en stark benägenhet att ta upp lipidmolekyler.
Hon diskuterade detta med Robert Langer, professor vid David Koch-institutet, som är allmänt känd för sitt avgörande arbete med nanopartikeltillförsel av läkemedel; de bestämde sig för att testa idén att minska PU.1-uttryck med en LNP-levererad siRNA.
"Jag minns fortfarande dagen när jag bad om att få träffa Bob för att diskutera idén om att testa LNPs som en nyttolast för att rikta in mig på inflammatorisk mikroglia", säger Tsai, en fakultetsmedlem vid institutionen för hjärn- och kognitionsvetenskap. "Jag är mycket tacksam mot The JPB Foundation, som stödde denna idé utan några preliminära bevis."
Langer Labs doktorand Jason Andresen och tidigare Tsai Lab postdoc William Ralvenius ledde arbetet och är studiens huvudförfattare. Owen Fenton, en före detta Langer Lab postdoc som nu är biträdande professor vid University of North Carolinas Eshelman School of Pharmacy, är en motsvarande författare tillsammans med Tsai och Langer. Langer är professor i kemiteknik, biologisk teknik och Koch Institute for Integrative Cancer Research.
Det enklaste sättet att testa om siRNA terapeutiskt kunde undertrycka PU.1-uttryck skulle ha varit att använda en redan tillgänglig leveransanordning, men en av de första upptäckterna i studien är att ingen av åtta kommersiellt tillgängliga reagenser säkert och effektivt kunde transfektera odlade mänskliga mikroglia-liknande celler i labbet.
Istället var teamet tvunget att optimera en LNP för att göra jobbet. LNP har fyra huvudkomponenter, och genom att ändra strukturerna för två av dem och variera förhållandet mellan lipider och RNA kunde forskarna komma på sju formuleringar att prova. Viktigt är att deras tester inkluderade att prova deras formuleringar på odlade mikroglia som de hade inducerat till ett inflammatoriskt tillstånd. Det tillståndet är trots allt det där den föreslagna behandlingen behövs.
Bland de sju kandidaterna stod en av teamet som heter "MG-LNP" ut för sin särskilt höga leveranseffektivitet och säkerhet för en test-RNA-last.
Det som fungerar i en maträtt fungerar ibland inte i en levande organism, så teamet testade sedan deras LNP-formuleringars effektivitet och säkerhet i möss. Genom att testa två olika metoder för injektion, i kroppen eller i cerebrospinalvätskan (CSF), fann de att injektion i CSF säkerställde mycket större effektivitet för att rikta in mikroglia utan att påverka celler i andra organ.
Bland de sju formuleringarna visade sig MG-LNP återigen vara den mest effektiva för att transfektera mikroglia. Langer sa att han tror att detta potentiellt kan öppna nya sätt att behandla vissa hjärnsjukdomar med nanopartiklar en dag.
När de visste att MG-LNP kunde leverera en testlast till mikroglia både i mänskliga cellkulturer och möss, testade forskarna sedan om användningen av den för att leverera en PU.1-undertryckande siRNA kunde minska inflammation i mikroglia. I cellkulturerna uppnådde en relativt låg dos en 42-procentig minskning av PU.1-uttrycket (vilket är bra eftersom mikroglia behöver åtminstone lite PU.1 för att leva).
MG-LNP-transfektion orsakade faktiskt inte cellerna någon skada. Det minskade också avsevärt transkriptionen av generna som PU.1-uttrycket ökar i mikroglia, vilket indikerar att det kan minska flera inflammatoriska markörer.
I alla dessa och andra åtgärder överträffade MG-LNP ett kommersiellt tillgängligt reagens som heter RNAiMAX som forskarna testade parallellt.
"Dessa fynd stödjer användningen av MG-LNP-medierad anti-PU.1 siRNA-leverans som en potentiell terapi för neuroinflammatoriska sjukdomar", skrev forskarna.
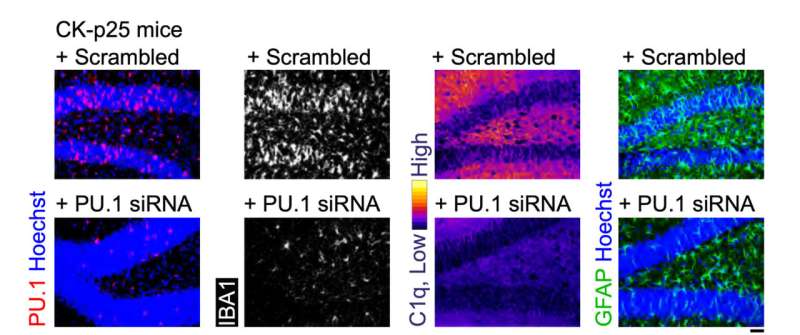
Den sista uppsättningen av tester utvärderade MG-LNP:s prestanda och levererade siRNA i två musmodeller av inflammation i hjärnan. I ett exponerades möss för LPS, en molekyl som simulerar infektion och stimulerar ett systemiskt inflammationssvar. I den andra modellen uppvisar möss allvarlig neurodegeneration och inflammation när ett enzym som kallas CDK5 blir hyperaktiverat av ett protein som kallas p25.
I båda modellerna reducerade injektion av MG-LNP som bär anti-PU.1 siRNA uttrycket av PU.1 och inflammatoriska markörer, ungefär som i odlade mänskliga celler.
"MG-LNP-tillförsel av anti-PU.1-siRNA kan potentiellt användas som ett antiinflammatoriskt läkemedel hos möss med systemisk inflammation och i CK-p25-musmodellen för AD-liknande neuroinflammation," avslutade forskarna och kallade resultaten för en "bevis på principen." Fler tester kommer att krävas innan idén kan prövas på mänskliga patienter.
Mer information: William T. Ralvenius et al, Nanopartikelmedierad leverans av anti-PU.1 siRNA via lokaliserad intrasisternal administrering minskar neuroinflammation, Avancerat material (2023). DOI:10.1002/adma.202309225
Journalinformation: Avancerat material
Tillhandahålls av Massachusetts Institute of Technology