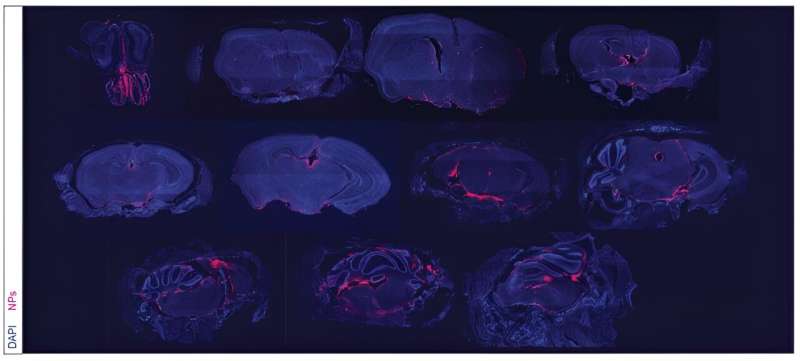
Med hjälp av nanopartiklar som administreras direkt i cerebrospinalvätskan (CSF) har ett forskarlag utvecklat en behandling som kan övervinna betydande utmaningar vid behandling av en särskilt dödlig hjärncancer.
Forskarna, ledda av professorerna Mark Saltzman och Ranjit Bindra, gav möss med medulloblastom en behandling som innehåller specialdesignade läkemedelsbärande nanopartiklar. Studien, publicerad i Science Translational Medicine , visade att möss som fick denna behandling levde betydligt längre än möss i kontrollgruppen.
Medulloblastom, en hjärncancer som främst drabbar barn, börjar ofta med en tumör djupt inne i hjärnan. Cancern är benägen att spridas längs två skyddande membran som kallas leptomeninges i hela det centrala nervsystemet, särskilt ytan av hjärnan och CSF.
Leptomeningeal spridning ses i ett antal primära hjärntumörer, såväl som i hjärnmetastaser från solida tumörer i bröst, lunga och andra platser. Eftersom det inte finns några anatomiska barriärer i CSF för att förhindra ytterligare tillväxt, kan dessa cancerformer spridas snabbt.
Att rikta in sig på tumörer i CSF har visat sig vara svårt, delvis på grund av att vätskan snabbt cirkulerar genom centrala nervsystemet cirka fyra gånger om dagen hos människor, vilket vanligtvis spolar bort antitumörläkemedel innan de har haft en chans att ackumuleras och ha någon effekt.
"Det är som ett vattenfallssystem, med ett snabbt, snabbt vätskeflöde", säger Minsoo Khang, huvudförfattare till studien och en före detta doktorand i Saltzmans labb.
För att komma runt detta hinder tillverkade forskargruppen nanopartiklar som fäster vid tumörer. Designade i Saltzmans labb, är dessa nanopartiklar tillverkade med nedbrytbara polymerer som långsamt frisätter en DNA-reparationshämmare, talazoparib, som är FDA-godkänd och för närvarande används på kliniken för ett antal cancerformer. Läkemedlet är ett av en relativt ny klass av cancerläkemedel som kallas PARP-hämmare, som blockerar ett enzym som hjälper till att reparera DNA. Utan förmågan att reparera sitt DNA är det mer sannolikt att tumörceller dör.
Nanopartikelbehandlingen injiceras intratekalt - det vill säga den levereras direkt mellan de leptomeninges som skyddar CSF. Under en period av veckor upptäckte forskarna närvaron av nanopartiklar i CSF så länge som 21 dagar efter en enda dosering.
"Vi var väldigt glada över att ha hittat ett medium som har långvarig retention i detta flytande utrymme, vilket annars är utmanande," sa Khang.
Att behandla hjärncancer i allmänhet är utmanande eftersom få behandlingar kan penetrera blod-hjärnbarriären, ett naturligt försvarssystem som kan blockera potentiellt användbara läkemedel. Forskargruppens metod skulle kunna erbjuda en lösning.
"Det har gjorts väldigt lite arbete med intratekal leverans av nanopartiklar, så vi är väldigt glada eftersom det kan göra det möjligt för oss att gå efter leptomeningeal spridning av sjukdomar från hjärnmetastaser", säger Bindra, professorn vid Harvey och Kate Cushing i terapeutisk radiologi och professor i Patologi. "Detta har verkligen öppnat upp ett helt nytt sätt att behandla dessa patienter, även om mycket mer arbete måste göras."
Genom att använda nanopartiklarna för att rikta in sig på tumörerna kunde forskarna använda läkemedlet talazoparib, som har visat sig vara effektivt i ett antal solida tumörer utanför hjärnan. Eftersom läkemedlet har begränsats till ingen penetration av det centrala nervsystemet, skulle dock en oralt tillförd dos ha begränsad effekt mot tumörer med leptomeningeal spridning.
"Genom att kapsla in den i en nanopartikel och direkt injicera den i CSF får vi nu mycket hög exponering inom just det området", säger Saltzman, Goizueta Foundation professor i biomedicinsk teknik, kemi- och miljöteknik och fysiologi, och medlem i Yale Cancer Center.
Genom att tillföra läkemedlet intratekalt undviker man också att injicera det direkt i hjärnan, en teknik som kallas konvektionsförstärkt tillförsel, en mycket utmanande procedur som bara kan utföras några få gånger om året. Intratekala injektioner är däremot mycket mindre invasiva och kan ges utan sjukhusvistelse.
"Detta är enormt för oss, för nu kan vi göra flera nanopartikelbehandlingar över tiden," sa Bindra.
Förutom nanopartikelinjektionen fick mössen också en oral dos av ett kemoterapiläkemedel som kallas temozolomid.
"Det är en ny plattform där vi kan ge dessa orala kemoterapier som tar sig över blod-hjärnbarriären och ett målinriktat medel bara i det centrala nervsystemet," sa Bindra. "I huvudsak kommer denna uppdelning av kombinationsterapi att förbättra synergistisk tumörcellsdöd samtidigt som systemisk toxicitet minimeras."
Mössen som fick den nanopartikelbaserade behandlingen levde betydligt längre än mössen som fick läkemedelsbehandling som inte använde nanopartiklar, och till och med längre än mössen som inte fick någon behandling. Dessutom var det mycket mindre spridning av cancern hos mössen som fick de läkemedelsbärande nanopartiklarna.
Forskarna sa att nästa steg kommer att vara att validera metoden i större djurmodeller, så småningom följt av mänskliga tester. Teamet planerar också att testa behandlingsmetoden på andra cancerformer, särskilt de som tenderar att spridas till hjärnan.
Mer information: Minsoo Khang et al, Intratekal leverans av nanopartikel PARP-hämmare till cerebrospinalvätskan för behandling av metastaserande medulloblastom, Science Translational Medicine (2023). DOI:10.1126/scitranslmed.adi1617
Journalinformation: Science Translational Medicine
Tillhandahålls av Yale University