Att inrikta sig på maligna tumörer med hög precision är en utmaning för biomedicinska forskare. Men det här scenariot kommer sannolikt att bevittna ett paradigmskifte inom en snar framtid genom användning av speciellt framställda bakterier som effektivt kan eliminera maligna celler.
Användning av bakterier för att rikta cancerceller, eller bakteriell terapi, kan förbättras ytterligare genom genteknik och nanoteknik. Dess effektivitet kan dock hindras på grund av tekniska begränsningar och den potentiella utvecklingen av antibiotikaresistens. Därför är det avgörande att uppnå en måttlig men effektiv kemisk modifiering av bakterier för förbättrad biokompatibilitet och funktionalitet, så att deras medicinska förmågor inte äventyras.
Nyligen har vissa typer av lila fotosyntetiska bakterier (PPSB) kommit i rampljuset för deras potential att ta itu med utmaningarna med bakterieterapi. För att utforska detta ytterligare publicerade forskare en studie i Nano Today som rapporterar användningen av kemiskt modifierad PPSB för att upptäcka och eliminera svåra att utrota cancerceller i en musmodell.
Studien, ledd av docent Eijiro Miyako från Japan Advanced Institute of Science and Technology (JAIST), valde Rhodopseudomonas palustris (RP) som den optimala bakterien för att genomföra studierna. "RP visade utmärkta egenskaper, såsom nära-infraröd (NIR) fluorescens, fototermisk omvandling och låg cytotoxicitet. Det absorberar NIR-ljus och producerar fria radikaler - en egenskap som kan användas för att döda cancerceller", förklarar Prof. Miyako.
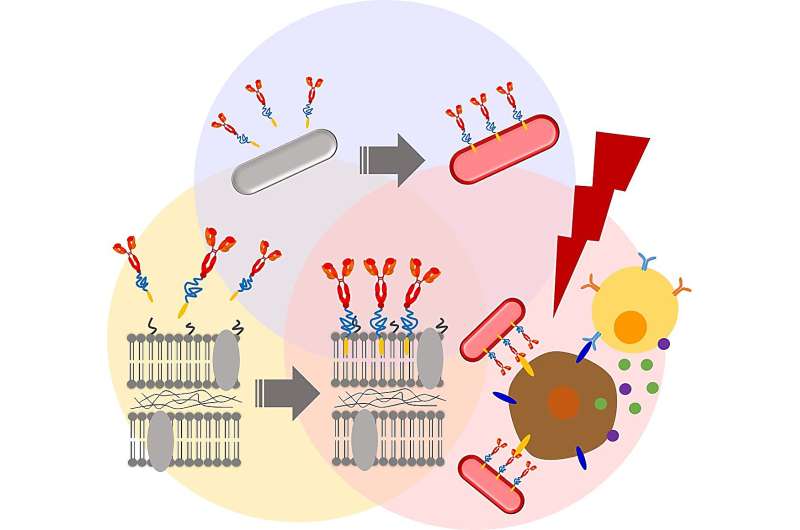
I ett försök att förbättra den terapeutiska effekten av den isolerade stammen sökte teamet kemiska modifieringar för att förändra bakteriemembranen. Först utförde de membran-PEGylering, eller fästningen av polyetylenglykolderivat till bakteriecellsväggarna. Tidigare forskning tyder på att bakteriell PEGylering hjälper till att undvika värdens immunsvar och omvandlar ljusenergi till värme, som sedan kan användas för att selektivt eliminera cancerceller.
De första resultaten var uppmuntrande. Till exempel påverkade beläggning av RP-membranytan med ett biokompatibelt ankare för membran (BAM) inte negativt RP-cells viabilitet under minst en vecka. Dessutom eliminerades de BAM-funktionaliserade RP inte via fagocytos av makrofager – celler som spelar en nyckelroll i immunsystemets defensiva åtgärder mot bakteriella invasioner.
Därefter fäste forskarna ett fluorescerande Alexa488-BSA-konjugat till de BAM-funktionaliserade RP:erna, vilket skapade ett bakteriekomplex med en spårbar fluorescerande markör. Detta konjugat ersattes därefter med en PD-L1-antikropp. Tidigare studier har visat att cancerceller uttrycker ett protein som kallas programmerad celldödsligand 1 (PD-L1) på sin yta. PD-L1 kan smidigt stänga av värdförsvarssystemet genom att binda till PD-1-receptorer. Detta gör att cancercellerna kan undvika immundetektering och eliminering. Anti-PD-L1-antikroppar blockerar denna interaktion och förhindrar därmed cancerceller från att kringgå immunsystemmedierad förstörelse.
Som väntat hämmade både anti-PD-L1-BAM-RP och RP tumörtillväxt i en murin modell av tjocktarmscancer. Men anti-PD-L1–BAM–RP, BAM–RP och RP, när de exciterades med en laser, visade en särskilt dramatisk anticancereffekt. Faktum är att solida tumörer försvann helt efter laserbestrålningen av anti-PD-L1-BAM-RP, BAM-RP eller RP som injicerades i tumörbärande möss. Vid bedömning av fototermiska omvandlingsegenskaper uppvisade dessutom både anti-PD-L1–BAM–RP och naturligt RP stark fototermisk omvandling på grund av närvaron av ljusdrivna bakterioklorofyll (BChl)-molekyler.
Bland de olika biokonjugaten visade anti-PD-L1–BAM–RP den högsta effekten i det inledande skedet av behandlingen. Dessutom var det inte giftigt för omgivande friska celler eller för den murina värden. Efterföljande experiment avslöjade den underliggande mekanismen för kolontumörförintelse i musmodellen.
"Våra fynd avslöjade att ljusdrivna funktionella bakterier visade effektiva optiska och immunologiska funktioner i den murina modellen av tjocktarmscancer. Dessutom användes NIR-fluorescensen av de konstruerade bakteriekomplexen för att lokalisera tumörer, vilket effektivt banade väg för framtida klinisk översättning." säger prof. Miyako.
Han tillägger vidare, "Vi tror att denna bakteriella teknologi kan vara tillgänglig för kliniska prövningar om 10 år och ha positiva konsekvenser för cancerdiagnostik och terapi."
Mer information: Sheethal Reghu et al, Cancer immunotheranostics using bioactive nanocoated photosynthetic bacterial complexes, Nano Today (2023). DOI:10.1016/j.nantod.2023.101966
Journalinformation: Nano idag
Tillhandahålls av Japan Advanced Institute of Science and Technology