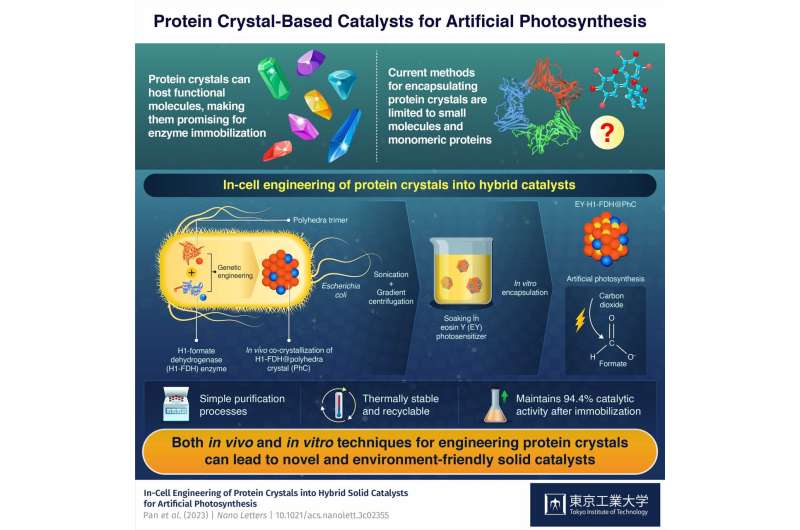
In-cell engineering kan vara ett kraftfullt verktyg för att syntetisera funktionella proteinkristaller med lovande katalytiska egenskaper, visar forskare vid Tokyo Tech. Med hjälp av genetiskt modifierade bakterier som en miljövänlig syntesplattform producerade forskarna fasta hybridkatalysatorer för artificiell fotosyntes. Dessa katalysatorer uppvisar hög aktivitet, stabilitet och hållbarhet, vilket framhäver potentialen hos det föreslagna innovativa tillvägagångssättet.
Proteinkristaller, liksom vanliga kristaller, är välordnade molekylära strukturer med olika egenskaper och en enorm potential för anpassning. De kan byggas naturligt av material som finns i celler, vilket inte bara kraftigt minskar synteskostnaderna utan också minskar deras miljöpåverkan.
Även om proteinkristaller är lovande som katalysatorer eftersom de kan vara värd för olika funktionella molekyler, möjliggör nuvarande tekniker endast vidhäftning av små molekyler och enkla proteiner. Därför är det absolut nödvändigt att hitta sätt att producera proteinkristaller som bär både naturliga enzymer och syntetiska funktionella molekyler för att utnyttja deras fulla potential för enzymimmobilisering.
Mot denna bakgrund har ett team av forskare från Tokyo Institute of Technology (Tokyo Tech) under ledning av professor Takafumi Ueno utvecklat en innovativ strategi för att producera fasta hybridkatalysatorer baserade på proteinkristaller. Som förklaras i deras artikel publicerad i Nano Letters den 12 juli 2023 kombinerar deras tillvägagångssätt in-cell engineering och en enkel in vitro-process för att producera katalysatorer för artificiell fotosyntes.
Byggstenen i hybridkatalysatorn är en proteinmonomer som härrör från ett virus som infekterar silkesmasken Bombyx mori. Forskarna introducerade genen som kodar för detta protein i Escherichia coli-bakterier, där de producerade monomererna bildade trimerer som i sin tur spontant sammanfogades till stabila polyhedrakristaller (PhCs) genom att binda till varandra genom deras N-terminala α-helix (H1) ).
Dessutom introducerade forskarna en modifierad version av genen formatdehydrogenas (FDH) från en jästart i E. coli-genomet. Denna gen fick bakterierna att producera FDH-enzymer med H1-terminaler, vilket ledde till bildningen av hybrid H1-FDH@PhC-kristaller i cellerna.
Teamet extraherade hybridkristallerna ur E. coli-bakterierna genom sonikering och gradientcentrifugering och blötlade dem i en lösning innehållande en artificiell fotosensibilisator som kallas eosin Y (EY). Som ett resultat underlättade proteinmonomererna, som hade modifierats genetiskt så att deras centrala kanal kunde vara värd för en eosin Y-molekyl, den stabila bindningen av EY till hybridkristallen i stora mängder.
Genom denna geniala process lyckades teamet producera mycket aktiva, återvinningsbara och termiskt stabila EY·H1-FDH@PhC-katalysatorer som kan omvandla koldioxid (CO2 ) till format (HCOO − ) vid exponering för ljus, efterliknar fotosyntesen. Dessutom bibehöll de 94,4 % av sin katalytiska aktivitet efter immobilisering jämfört med det fria enzymet.
"Omvandlingseffektiviteten för den föreslagna hybridkristallen var en storleksordning högre än den för tidigare rapporterade föreningar för enzymatisk artificiell fotosyntes baserad på FDH", säger prof. Ueno. "Dessutom förblev hybrid-PhC i det fasta proteintillståndet efter att ha uthärdat både in vivo- och in vitro-tekniska processer, vilket visar den anmärkningsvärda kristalliseringskapaciteten och starka plasticiteten hos PhCs som inkapslande byggnadsställningar."
Sammantaget visar denna studie potentialen hos bioteknik för att underlätta syntesen av komplexa funktionella material. "Kombinationen av in vivo och in vitro-tekniker för inkapsling av proteinkristaller kommer sannolikt att ge en effektiv och miljövänlig strategi för forskning inom områdena nanomaterial och artificiell fotosyntes", avslutar prof. Ueno.
Mer information: Tiezheng Pan et al, In-Cell Engineering of Protein Crystals into Hybrid Solid Catalysts for Artificiell fotosyntes, Nano Letters (2023). DOI:10.1021/acs.nanolett.3c02355
Journalinformation: Nanobokstäver
Tillhandahålls av Tokyo Institute of Technology