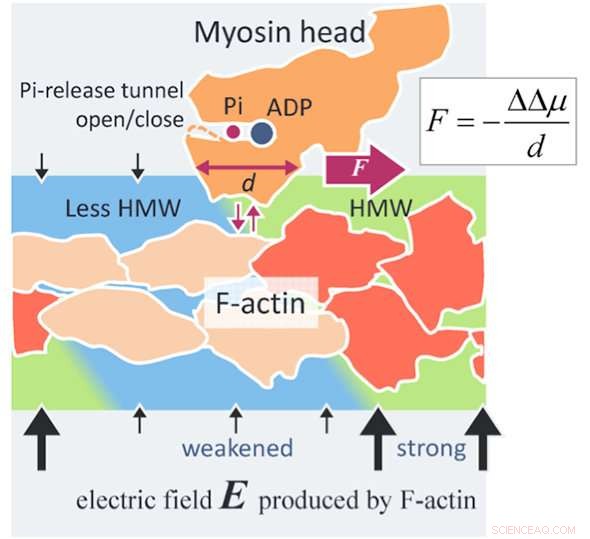
En ny kraftgenereringsmekanism för aktomyosin. Ett aktinfilament (F-aktin) producerar ett elektriskt fält (svarta pilar) så högt som 100 MV/m runt F-aktin på grund av dess negativa ytladdningar. Vattenmolekylerna i ett så högt elektriskt fält blir hypermobila vattenmolekyler (HMW, ljusgrön) i omedelbar närhet av F-aktin. Å andra sidan, ATP i lösning binder med ett myosinhuvud (orange) och delas upp i adenosindifosfat (ADP) och oorganiskt fosfat (Pi) i huvudet. När myosinhuvudet med ADP och Pi binder till F-aktin (orangeröd), flera aktinsubenheter ändrar sina strukturer (beige). Då minskar den elektriska fältstyrkan runt dessa förändrade aktinsubenheter och HMW-intensiteten minskar också (ljusblå) för att bli nära fritt vatten. I föreliggande studie, proteinhydratiseringstillståndet har visat sig vara mer stabilt i den starkare HMW-regionen. I figuren, myosinhuvudet drivs till höger där HMW-intensiteten är starkare (ljusgrön), med att lossna från F-aktin och fästa igen med F-aktin. Kraften som utvärderas med föreliggande metod är så hög som flera piconewtons, vilket är på nivå med de experimentella värdena. Detta kan vara en princip för ny ytkraft som verkar mellan en laddad makromolekyl, som protein och DNA, och ett löst protein som är allmänt användbart inom vetenskap och teknologi. Kredit:Makoto Suzuki
Aktin- och myosinkomplexet (aktomyosin) genererar kontraktionskraften hos en muskel genom att använda adenosintrifosfat (ATP) hydrolysreaktionen. Många försök har sålunda gjorts för att förklara det molekylära ursprunget för aktomyosin-rörligheten.
En myosin power stroke modell, föreslog av Huxley och Simmons 1971, initierade mycket forskning inklusive atomstrukturstudier och undersökningen av molekylärbiologin hos myosin- och aktinmolekyler. Power stroke-modellen, ändrat på sistone, är allmänt antagen i vanliga biologiläroböcker.
Dock, det kvarstår ett allvarligt problem. Enligt experimentella termodynamiska data, ATP-hydrolysen i myosinhuvudet producerar inte ett myosintillstånd med tillräckligt hög energi för att generera kontraktionskraften.
Nu, en forskargrupp, ledd av emeritusprofessor Makoto Suzuki vid Tohoku University i samarbete med professor Nobuyuki Matubayasi vid Osaka University, har lyckats förklara actomyosin-drivmekanismen enligt experimentell termodynamikdata.
I studien, vattenstrukturen i omedelbar närhet av ett aktinfilament (F-aktin) modifieras vid bindning med ett myosinhuvud som hydrolyserar ATP till F-aktin, som leder till en förändring i affiniteten till myosinhuvudet och därmed till genereringen av drivkraften för actomyosin.
Närvaron av den nya intermolekylära ytkraften - som demonstrerades för första gången baserat på nuvarande hydratiseringsanalyser - var en markant upptäckt. Denna artikel är, därför, den första som framgångsrikt avslöjade aktomyosindrivmekanismen genom att introducera en ny intermolekylär ytkraft.