Vid läkemedelsleverans begränsas nanobärarnas terapeutiska beteende av den "främmande" karaktären på deras yta. Trots det breda utbudet av sofistikerade beläggningar som finns tillgängliga, identifierar immunceller ofta dessa syntetiska nanopartiklar, genererar negativa svar eller visar stark ackumulering utanför målet.
I denna mening framträder användningen av biomimetiska material som ett alternativ för att kringgå detta erkännande och förbättra effektiviteten hos leveranssystem. Genom att dra fördel av homotypiska egenskaper visar biomimetiska vektorer en högre affinitet för cellmikromiljön och värdefull immunflyktsförmåga.
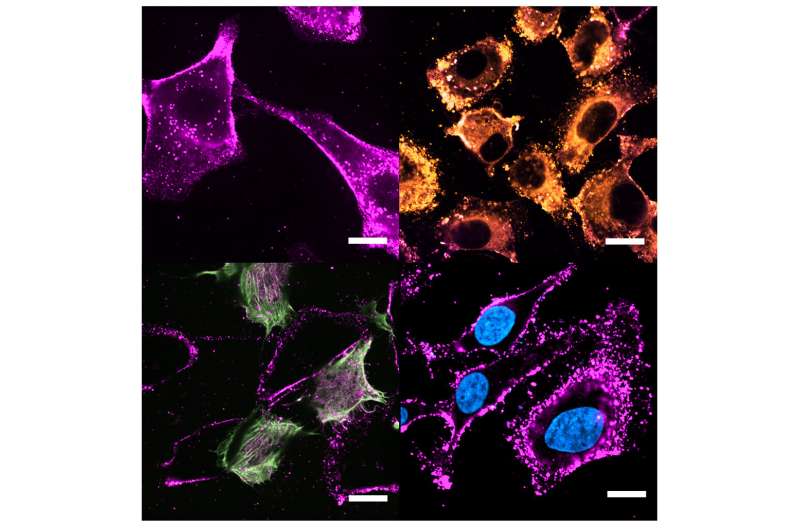
Detta tillvägagångssätt ledde till att forskare från Center for Research in Biological Chemistry and Molecular Materials (CiQUS) efterliknade membransammansättningen av tumörceller och utvecklade nya lipidbaserade nanobärare som smälter samman med värdcellmembranet för att frigöra bioaktiva molekyler. En mycket exakt kombination av katjoniska (positivt laddade) och neutrala lipider inlagda i det biomimetiska skalet ger nanobärare denna fusogena egenskap och främjar dess bindning till plasmamembranet. Forskningen publiceras i Journal of Colloid and Interface Science .
"Genom att kombinera fusogena egenskaper och biomimetiska egenskaper uppnådde vi intracellulär lokalisering av flera typer av nyttolaster, från små molekyler till stora makromolekyler och fasta nanopartiklar", säger Dr. Ester Polo, CiQUS-forskare och medlem av BioNanoTools-gruppen. Denna fusion möjliggör direkt frisättning av läkemedel och andra molekyler av intresse i cytosolen, vilket förbättrar den terapeutiska effekten av tillförselsystemet och biotillgängligheten för de transporterade föreningarna.
Forskarna har försett det nya systemet med en dubbel funktion som syftar till att öka selektiviteten och säkerheten för läkemedelstillförsel jämfört med mer konventionella metoder. "På grund av deras homotypiska egenskaper uppvisar dessa cellhärledda nanobärare en hög selektivitet. Å andra sidan tillåter fusionskapaciteten som tillhandahålls av den specifika kombinationen av lipider frigörandet av lasten mycket mer effektivt", sa de.
Mer information: Enrica Soprano et al, Fusogenic Cell-Derived nanocarriers for cytosolic delivery of last inside living cells, Journal of Colloid and Interface Science (2023). DOI:10.1016/j.jcis.2023.06.015
Tillhandahålls av Center for Research in Biological Chemistry and Molecular Materials (CiQUS)