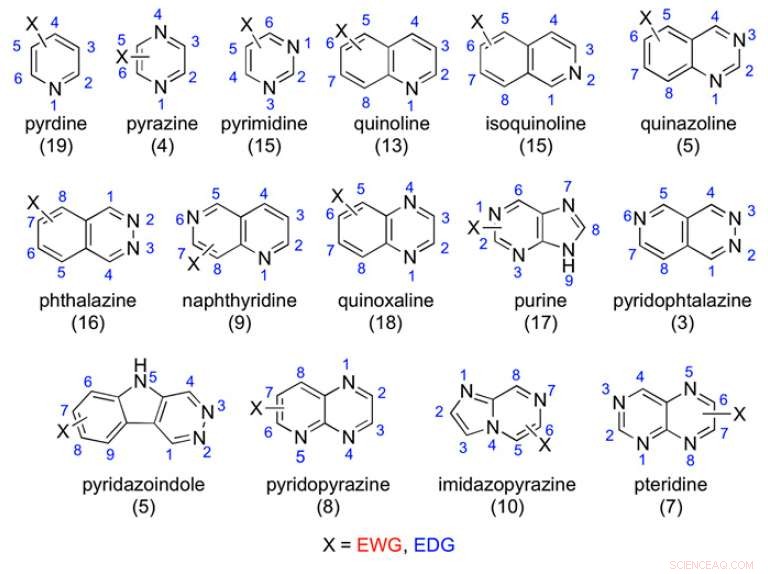
Exempel på studerade aza-aromatiska ställningar:antalet testade föreningar anges inom parentes. Kredit:(c) Proceedings of the National Academy of Sciences (2017). DOI:10.1073/pnas.1618881114
(Phys.org) – Läkemedelsdesign involverar guidad trial-and-error. Hur kroppen metaboliserar ett visst läkemedel är viktigt för att bestämma läkemedlets effektivitet. Det har gjorts många studier för att förstå hur xenobiotika interagerar med cytokrom P450, en viktig klass av enzymer i läkemedelsmetabolism, men lite forskning har gjorts för att förstå aldehydoxidas (AOX) metabolism. AOX, ligger i levern, spelar en viktig roll i läkemedelsmetabolism; dock, många potentiella läkemedel slutar misslyckas under sena prövningar på grund av deras interaktion med AOX.
För att bättre förstå struktur-metabolismförhållandet mellan funktionella grupper och AOX samt att fastställa allmänna riktlinjer för icke-cytokrom P450 läkemedelsmetabolism, forskare från University of Perguia i Italien genomförde tester på 198 föreningar med aza-aromatiska ställningar för att se vilka som oxiderades av AOX. Vidare, de testade 75 amidställningar för att avgöra vilka som hydrolyserades. De fann att elektroniska faktorer såväl som steriska hinder påverkade molekylens orientering i MoCos aktiva plats, som bestämde huruvida föreningen metaboliserades av AOX. Deras arbete visas i Proceedings of the National Academy of Sciences .
AOX är ett enzym som finns i levern och som tenderar att oxidera aza-aromatiska föreningar som en fas I-metabolit. Studier har visat att AOX aktiverar det osubstituerade kolet orto till kvävet på aza-heterocykeln. Eftersom detta är det mest elektropositiva kolet i den aromatiska ringen, elektrondensitet spelar sannolikt en roll i AOX-aktivering. Men dessa studier, såväl som andra som tittar på AOX-metabolism, var baserade på ett litet antal molekyler som inte gör det möjligt att härleda ett allmänt mönster för struktur-metabolismsamband.
I den aktuella studien, Lepri et al. testade 198 aza-aromatiska föreningar för att se om de oxiderades av AOX. Var och en av dessa hade typiska aza-aromatiska ställningar med variationer på elektronbortdragande och elektrondonerande substituenter. De antingen förvärvade eller gjorde denna katalog av föreningar och genomförde sedan metabolismstudier in vitro med användning av human levercytosol.
DFT-beräkningar användes för att belysa effekterna av elektrondensitet för AOX-aktivitet. Stället för metabolism på den aromatiska föreningen tenderade att motsvara det mest elektropositiva osubstituerade kolet, som förväntat. Dessutom, beräkningsstudier användes för att utföra dockningsanalys av föreningarna i det aktiva stället för AOX.
Författarna hittade några trender för platsen för metabolism; dock, dessa trender kompliceras av flera faktorer. Pyridinställningen var den enda som, som en ställningsklass, var inte mottaglig för AOX-metabolism. De andra grupperna var starkt beroende av elektrontätheten på vissa kol eller, som författarna fann med föreningar som kinoxaliner och vissa bicykliska föreningar, steriskt hinder i det aktiva stället förhindrade AOX-metabolism.
Lepri et al. testade även 73 amidföreningar för att se om AOX hydrolyserade amidbindningen. I allmänhet, om det fanns en elektronbortdragande grupp i ortoposition på analinen, då oxiderade AOX det inte. Om det fanns en elektrondonerande grupp, då gjorde det det. Meta- och paraversionerna av elektrondonerande och elektronbortdragande grupper var inte mottagliga för AOX-metabolism.
Exponeringseffekter var en viktig komponent för huruvida en förening metaboliserades av AOX. Detta har att göra med molekylens orientering mot MoCo-centret i AOX:s aktiva plats. Vissa skrymmande grupper resulterade i ingen aktivitet där en förväntades baserat på beräkningsstudier. Dessutom, hydrofobicitet påverkade också hur föreningen interagerade med det aktiva stället. När det reaktiva kolet exponeras för MoCo-centret, då metaboliseras föreningen lätt. Men, när den oreaktiva delen av föreningen är orienterad mot MoCo-centrum, då är det mindre sannolikt att föreningen oxideras eller hydrolyseras.
Författarna påpekar att från dessa experiment "framgår det att det inte alls är enkelt att förutsäga om en förening är ett substrat för AOX eller inte." Svårigheten ligger i att förstå reaktiviteten hos det elektrofila kolet på föreningen samt hur den specifika föreningen kommer att orientera sig i enzymets aktiva plats. Dock, denna studie ger en startpunkt för ytterligare studier och mer sofistikerade modelleringstekniker.
© 2017 Phys.org