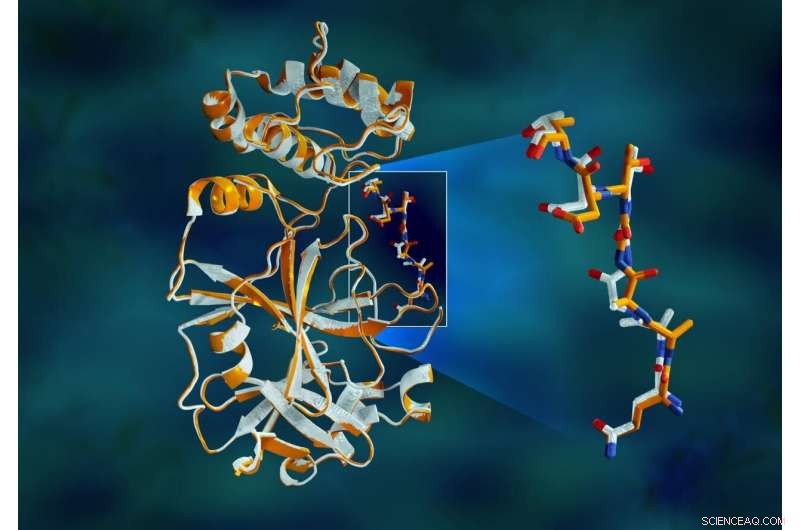
Överlappande röntgendata för SARS-CoV-2-huvudproteaset visar strukturella skillnader mellan proteinet vid rumstemperatur (orange) och den kryogeniskt frusna strukturen (vit). Upphovsman:Jill Hemman/ORNL, USA:s avdelning för energi
Ett team av forskare vid Department of Energy:s Oak Ridge och Argonne nationella laboratorier har utfört de första röntgenmätningarna vid rumstemperatur på huvudproteaset SARS-CoV-2-enzymet som gör att viruset kan reproducera sig.
Röntgenmätningarna markerar ett viktigt första steg i forskarnas slutliga mål att bygga en omfattande 3D-modell av det enzymatiska proteinet. Modellen kommer att användas för att avancera superdatorsimuleringar som syftar till att hitta läkemedelshämmare för att blockera virusets replikationsmekanism och hjälpa till att avsluta COVID-19-pandemin. Deras forskningsresultat är offentligt tillgängliga och har publicerats i tidskriften Naturkommunikation .
SARS-CoV-2 är det virus som orsakar sjukdomen COVID-19. Viruset reproduceras genom att uttrycka långa proteinkedjor som måste skäras i mindre längder av proteasenzymet.
"Proteaset är oumbärligt för virusets livscykel. Proteinet är format som ett hjärtans hjärta, men det är verkligen hjärtat i viruset som gör det möjligt att replikera och sprida sig. Om du hämmar proteaset och stoppar hjärtat, viruset kan inte producera de proteiner som är nödvändiga för dess replikation. Det är därför proteaset anses vara ett så viktigt läkemedelsmål, "sa ORNL:s Andrey Kovalevsky, motsvarande författare. Även om strukturen är känd från kryogent bevarade kristaller, "Detta är första gången strukturen för detta enzym har mätts vid rumstemperatur, vilket är viktigt eftersom det är nära den fysiologiska temperaturen där cellerna fungerar. "
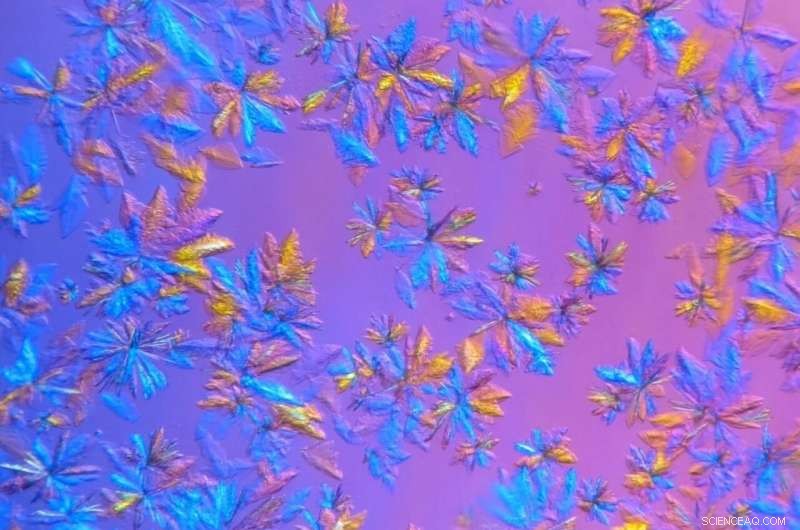
SARS-CoV-2 proteaskristaller, odlas i ORNL:s proteinkristalliserings- och karakteriseringslaboratorium och avbildas i mikroskopisk vy, kommer att användas i röntgenspridningsexperiment. Upphovsman:Daniel Kneller/ORNL, USA:s avdelning för energi
Att bygga en komplett modell av proteinstrukturen kräver att varje element i strukturen identifieras och hur de är arrangerade. Röntgenstrålar är idealiska för att upptäcka tunga element som kol, kväve- och syreatomer. På grund av röntgenstrålarnas intensitet vid de flesta storskaliga synkrotronanläggningar, biologiska prover måste vanligtvis kryogeniskt frysas till cirka 100 K, eller ungefär minus 280 grader Fahrenheit, att stå emot strålningen tillräckligt länge för att data ska samlas in.
För att förlänga livslängden för de kristalliserade proteinproven och mäta dem vid rumstemperatur, ORNL-forskare odlade kristaller större än vad som krävdes för synkrotronkryostudier och använde en egen röntgenmaskin som har en mindre intensiv stråle.
"Att odla proteinkristaller och samla in data är en tråkig och tidskrävande process. Under den tid det normalt tar att förbereda och skicka provet till en synkrotron, vi kunde odla kristallerna, ta mätningarna och börja analysera data, sa Daniel Kneller från ORNL, studiens första författare. "Och, när det finns en pandemi med många forskare som mobiliserar för att studera detta problem, det finns ingen dag kvar. "
Proteasenzymet består av kedjor av aminosyror med ett upprepat mönster av kväve-kol-kolatomer som bildar ryggraden i proteinet. Sidogrupper av aminosyrans byggstenar, eller "rester, "sträcker sig från var och en av de centrala ryggradskolatomerna. Enzymet viks till en specifik 3D-form, skapa speciella fickor där en läkemedelsmolekyl skulle fästa.
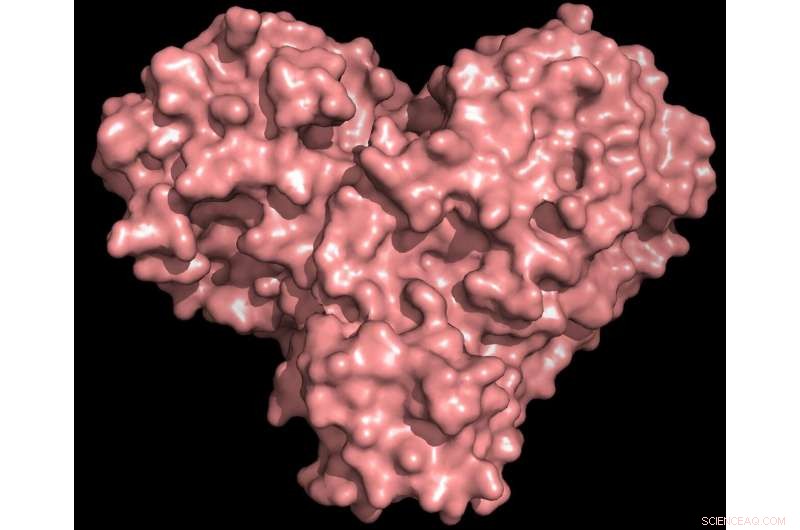
Proteasproteinet är både format som ett hjärta och fungerar som ett, så att viruset kan replikera och spridas. Hämning av proteaset skulle blockera virusreproduktion. Upphovsman:Kredit:Andrey Kovalevsky/ORNL, USA:s avdelning för energi
Studien avslöjade betydande strukturella skillnader mellan orienteringen av ryggraden och några av resterna i rumstemperatur och kryogena prover. Forskningen tyder på att frysning av kristallerna kan införa strukturella artefakter som kan resultera i en mindre exakt förståelse av proteasstrukturen.
Teamets resultat delas med forskare, ledd av ORNL-University of Tennessee guvernörsordförande Jeremy Smith, som genomför simuleringar för läkemedelsdockning med Summit på ORNL - landets snabbaste superdator.
"Det forskare gör på toppmötet är att ta kända läkemedelsföreningar och försöka beräkna dem till huvudproteaset för återanvändning av läkemedel, liksom att leta efter nya leads till andra potentiella läkemedelskandidater, "sade ORNL -motsvarande författare Leighton Coates." Våra rumstemperaturdata används för att bygga en mer exakt modell för dessa simuleringar och förbättra läkemedelsdesignaktiviteter. "
Forskarnas nästa steg för att slutföra 3D-modellen av SARS-CoV-2-huvudproteaset är att använda neutronspridning vid ORNL:s High Flux Isotope Reactor och Spallation Neutron Source. Neutroner är viktiga för att lokalisera väteatomerna, som spelar en kritisk roll i många av de katalytiska funktionerna och läkemedelsdesignarbetet.
Proteasplasmid -DNA som användes för att göra enzymet tillhandahölls av Argonnes strukturbiologiska center vid Advanced Photon Source. Kristallisation av proteinerna som används i röntgenspridningsförsöken utfördes vid ORNL:s centrum för strukturell och molekylär biologi.