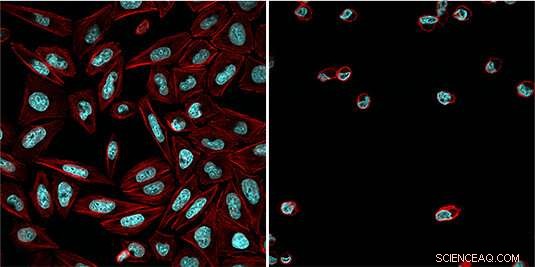
Celler behandlade med den ljusberoende inhibitorn (aktincytoskelett i rött, DNA i blått) efter exponering för blått ljus (höger) och utan att aktivera blåljusstrålning (vänster). Kredit:Esther Zanin
Forskare från Ludwig Maximilian University har designat en ljuskänslig hämmare som kan kontrollera celldelning och celldöd – och ger ett lovande tillvägagångssätt för studier av väsentliga cellulära processer och utvecklingen av nya tumörterapier.
Förmågan att exakt kontrollera biologiska och kemiska processer är en väsentlig del av både grundforskning och medicin. Ljus representerar en attraktiv stimulans i detta sammanhang, eftersom dess effekter kan moduleras noggrant både spatialt och tidsmässigt. Dessa önskvärda egenskaper är anledningen till att utvecklingen av ljuskontrollerbara molekyler har blivit ett så viktigt mål för biologiska kemister. Sådana verktyg lovar att ge betydande bidrag till förtydligandet av grundläggande cellulära funktioner, den detaljerade förståelsen av medicinska störningar och utformningen av nya terapeutiska strategier för att bekämpa dem. En grupp forskare under ledning av cellbiolog Esther Zanin vid LMU:s Biocenter, i samarbete med kemisten Henry Dube (som i april i år flyttade från LMU till universitetet i Erlangen-Nürnberg) har nu utvecklat en ljuskänslig kemisk hämmare, som tillåter dem att kontrollera två grundläggande cellulära processer, celldelning och celldöd, med ljus.
Celldelning är en viktig och mycket komplex process. Det är därför föremål för strikt reglering för att säkerställa att celler delar sig endast vid rätt tidpunkt och felfritt. Defekta celler elimineras genom programmerad celldöd (även känd som "apoptos"). Både korrekt celldelning och bortskaffande av defekta celler beror på en molekylär maskin som kallas proteasomen, som specifikt bryter ned cellulära proteiner som antingen är skadade eller inte längre behövs.
"Vi har nu modifierat en etablerad och mångsidig kemisk hämmare av proteosomen genom att lägga till en ljuskänslig skyddsgrupp till den, " säger Zanin. "Denna grupp blockerar den reaktiva aldehydfunktionen hos inhibitorn och förhindrar den från att binda till proteasomen." I mörkret, hämmaren är därför inaktiv och proteasomen fungerar normalt. Dock, exponering av cellerna för blått ljus lösgör skyddsgruppen, vilket gör det möjligt för inhibitorn att interagera med proteosomen och hämma dess funktion. Eftersom den aktiverande blåljusstrålningen kan riktas exakt, inhibitorns verkan kan kontrolleras mycket exakt. "Med detta betyder, vi kan stoppa delningen av tumörceller i ett specifikt skede av processen, och att utlösa apoptos på ett målinriktat sätt, " förklarar Zanin.
Hon och hennes kollegor tror att den nya ljuskänsliga proteosomhämmaren kommer att visa sig vara ett värdefullt verktyg för att studera ett brett spektrum av dynamiska cellulära processer – t.ex. i utvecklingssammanhang, under vilka celler och vävnader genomgår snabba och ofta radikala förändringar under kort tid och på begränsade platser. Dessutom, proteosomhämmare har lovande tillämpningar som terapeutiska medel - vid behandling av cancer, till exempel. "Förmågan att aktivera dessa föreningar specifikt i både tid och rum kan göra dem mer effektiva i framtiden, samtidigt som man minskar förekomsten av biverkningar, säger Zanin. Men, att nå detta mål kommer att kräva ytterligare arbete, eftersom hämmaren som används i den nya studien inte är lämplig för medicinsk användning i sin nuvarande form.