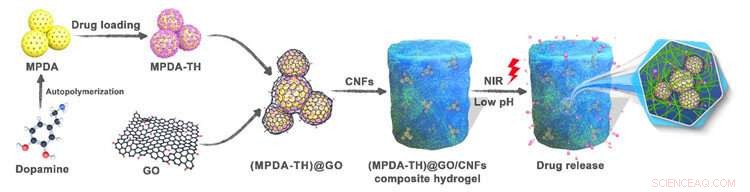
Utformningen av MPDA@GO/CNF inkapslingsstruktur och applikationen för kontrollerad läkemedelsfrisättning. Kredit:LIU Yingying
Intelligenta hydrogeler med flera funktioner som fördröjd läkemedelsfrisättningsförmåga med låg sprängfrisättning, antibakteriella egenskaper, och biokompatibilitet är mycket önskvärda inom biomaterialområdena, speciellt för cellulosabaserade läkemedelsbärare.
"Trots de nanocellulosabaserade hydrogelerna, som är lovande för tillämpningar av läkemedelsfrisättning, frågan om burst release i början av releasen behöver fortfarande åtgärdas, och läkemedelsfrisättningstiden behöver fortfarande förbättras ytterligare, " sa docent Li Bin, från Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT) vid den kinesiska vetenskapsakademin.
Nyligen, Metabolomics Group ledd av Prof. Cui Qiu från QIBEBT, i samarbete med forskare från Tianjin University of Science &Technology, konstruerade ett nytt läkemedelsladdningssystem med en inkapslingsstruktur för kontrollerbar läkemedelsfrisättning. Studien publicerades i ACS tillämpade material och gränssnitt den 8 dec.
Ett välkänt bredspektrumantibiotikum med låg toxicitet, tetracyklinhydroklorid (TH), användes som modellläkemedel. Forskarna genomförde fysisk tvärbindning av mesoporös polydopamin (MPDA) nanopartiklar inlindade med grafenoxid (GO) i cellulosa nanofibril (CNF) hydrogeler. De fick en ny MPDA@GO/CNFs komposithydrogel med flera svar, god mekanisk styrka och biokompatibilitet för kontrollerad läkemedelsfrisättning.
I denna inkapslingsstruktur, GO användes för att förpacka MPDA-nanopartiklar för att förlänga frisättningstiden för läkemedel, minska sprängfrisättning av läkemedlet, och förstärkning av den fysiska styrkan hos de erhållna hydrogelerna. De ihållande och kontrollerade läkemedelsfrisättningsbeteendena hos komposithydrogelerna var starkt beroende av pH-värdet, och hastigheten för läkemedelsfrisättning kunde accelereras genom strålning med nära infrarött ljus.
"Viktigt, denna inkapslingsstruktur visar god biokompatibilitet, och GO:s toxicitet kan väl skyddas av CNFs hydrogeler, ", sa Prof. Li. "Längre frisättningstid för läkemedel och lägre sprängfrisättning kan uppnås jämfört med de rapporterade bärarna för samma läkemedel av TH."
Denna nya design av den CNF-baserade inkapslingsstrukturen kommer att vara fördelaktig för utvecklingen av nya intelligenta läkemedelsladdningsmaterial, och har potentiella tillämpningar för kemiska och fysikaliska terapier.