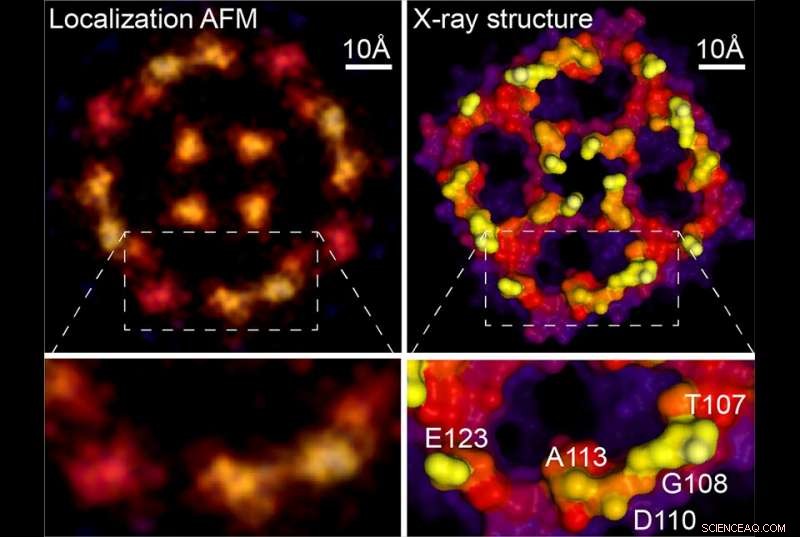
Lokalisering AFM &röntgenstruktur. Kredit:Weill Cornell Medicine, University of Leeds och Washington University
Forskare vid Weill Cornell Medicine har utvecklat en beräkningsteknik som avsevärt ökar upplösningen av atomkraftsmikroskopi, en specialiserad typ av mikroskop som "känner" atomerna vid en yta. Metoden avslöjar detaljer på atomnivå om proteiner och andra biologiska strukturer under normala fysiologiska förhållanden, öppnar ett nytt fönster om cellbiologi, virologi och andra mikroskopiska processer.
I en studie, publicerad 16 juni i Natur , utredarna beskriver den nya tekniken, som bygger på en strategi som används för att förbättra upplösningen i ljusmikroskopi.
Att studera proteiner och andra biomolekyler med hög upplösning, forskare har länge förlitat sig på två tekniker:röntgenkristallografi och kryo-elektronmikroskopi. Medan båda metoderna kan bestämma molekylära strukturer ner till upplösningen av enskilda atomer, de gör det på molekyler som antingen är byggnadsställningar till kristaller eller frysta vid extremt kalla temperaturer, eventuellt förändra dem från deras normala fysiologiska former. Atomkraftsmikroskopi (AFM) kan analysera biologiska molekyler under normala fysiologiska förhållanden, men de resulterande bilderna har varit suddiga och låg upplösning.
"Atomkraftsmikroskopi kan enkelt lösa atomer i fysik, på fasta ytor av silikater och på halvledare, så det betyder att maskinen i princip har precisionen för att göra det, " sa seniorförfattaren Dr Simon Scheuring, professor i fysiologi och biofysik i anestesiologi vid Weill Cornell Medicine. "Tekniken är lite som om du skulle ta en penna och scanna över Klippiga bergen, så att du får en topografisk karta över objektet. I verkligheten, vår penna är en nål som är vass ner till några få atomer och föremålen är enstaka proteinmolekyler."
Dock, biologiska molekyler har många små delar som vickar, sudda ut deras AFM-bilder. För att lösa det problemet, Dr Scheuring och hans kollegor anpassade ett koncept från ljusmikroskopi som kallas superupplösningsmikroskopi. "Teoretiskt sett var det inte möjligt med optisk mikroskopi att lösa upp två fluorescerande molekyler som var närmare varandra än halva ljusets våglängd, "sa han. Men genom att stimulera de intilliggande molekylerna att fluorescera vid olika tidpunkter, mikroskopister kan analysera spridningen av varje molekyl och lokalisera deras platser med hög precision.
Istället för att stimulera fluorescens, Dr Scheurings team noterade att de naturliga fluktuationerna av biologiska molekyler som registrerats under loppet av AFM-skanningar ger liknande spridningar av positionsdata. Första författare Dr George Heath, som var postdoktor vid Weill Cornell Medicine vid tidpunkten för studien och nu är fakultetsmedlem vid University of Leeds, engagerad i cykler av experiment och beräkningssimuleringar för att förstå AFM-avbildningsprocessen mer i detalj och extrahera maximal information från atomväxelverkan mellan spets och prov.
Genom att använda en metod som superupplösningsanalys, de kunde extrahera mycket högre upplösningsbilder av de rörliga molekylerna. Fortsätter den topografiska analogin, Dr Scheuring förklarade att "om stenarna (dvs. atomer) vicka lite upp och ner, du kan upptäcka denna, då den där, och sedan snittar du alla upptäckter över tiden och du får högupplöst information."
Eftersom tidigare AFM-studier rutinmässigt har samlat in nödvändiga data, den nya tekniken kan tillämpas retroaktivt på de suddiga bilder som fältet har genererat i decennier. Som ett exempel, det nya dokumentet inkluderar en analys av en AFM-skanning av ett aquaporinmembranprotein, ursprungligen förvärvad under Dr Scheurings doktorsavhandling. Omanalysen genererade en mycket skarpare bild som stämmer överens med röntgenkristallografistrukturer hos molekylen. "Du får i princip kvasiatomisk upplösning på dessa ytor nu, " sa Dr Scheuring. För att visa upp kraften i metoden, författarna tillhandahåller ny högupplöst data om annexin, ett protein som är involverat i cellmembranreparation, och på en proton-klorid-antiporter som de också rapporterar om strukturella förändringar relaterade till dess funktionella.
Förutom att tillåta forskare att studera biologiska molekyler under fysiologiskt relevanta förhållanden, den nya metoden har andra fördelar. Till exempel, Röntgenkristallografi och kryoelektronmikroskopi bygger på medelvärdesdata från ett stort antal molekyler, men AFM kan generera bilder av enstaka molekyler. "Istället för att ha observationer av hundratals molekyler, vi observerar en molekyl hundra gånger och beräknar en högupplöst karta, " sa Dr Scheuring.
Att avbilda enskilda molekyler när de utför sina funktioner kan öppna helt nya typer av analyser. "Låt oss säga att du har ett [viralt] spikprotein som finns i en konformation och sedan aktiveras det och går in i en annan konformation, " sade Dr Scheuring. "Du skulle i princip kunna beräkna en högupplöst karta från samma molekyl när den går från en konformation till nästa, inte från tusentals molekyler i den ena eller andra konformationen. "Sådana högupplösta enkelmolekyldata skulle kunna ge mer detaljerad information och undvika de potentiellt vilseledande resultaten som kan uppstå vid medelvärdesdata från många molekyler. Dessutom kan kartan kan avslöja nya strategier för att just omdirigera eller avbryta sådana processer.