
In vitro tillämpning av analys med användning av flera celltyper med simulering och hastighetsextraktion. (A) Fluorescensdata och analysinställningar som representerar otvättad QD (QSH) fluorescens för otvättade brunnar som innehåller njure (MES13), lever (AML12), endotelial (C166), och makrofag (J774a.1) celltyper. AU, godtyckliga enheter. (B) Tvättade råa (svarta) och kalibrerade (röda) fluorescensupptagskoncentrationer (cirklar, mätt) jämfört med simuleringspassningar (linjer) för lever, endotelial, makrofager, och njurcellstyper. (C) Sammanfattning av hastighetskonstanter optimerade av den genetiska algoritmen för modellanpassning till uppmätta datamängder. (D) Tidsberoende konfokalmikroskopibilder av QD-upptagning, visar mättnad (dubbelsidiga pilar) för varje celltyp i studien (blått och rött representerar cellkärnan Hoechst och QSH-fluorescens, respektive). Cartoon är en visuell representation av QD-cell interaktionskinetik. Kreditera: Vetenskapens framsteg , doi:10.1126/sciadv.aax2642
Bioingenjörer kan designa smarta läkemedel för antikropps- och nanomaterialbaserade terapier för att optimera läkemedelseffektiviteten för allt effektivare, prekliniska prövningar i ett tidigt skede. Det ideala läkemedlet kommer att ha maximal effektivitet vid målvävnadsställen för transport från vävnadskärlen till den cellulära miljön. Forskare kan använda biologiska simuleringar kopplade till in vitro-metoder för att förutsäga deras exponering snabbt och effektivt för att förutsäga läkemedelsbiodistribution inom enskilda celler av levande djurvävnad utan att förlita sig på djurstudier. I en ny studie nu publicerad på Vetenskapens framsteg , Edward Price och Andre J. Gesquiere använde framgångsrikt en in vitro-analys och beräkningsvätskedynamisk (CFD) modell för att översätta in vitro-cellkinetik till helkroppssimuleringar över flera arter och nanomaterialtyper. Arbetet gjorde det möjligt för dem att förutsäga läkemedelsfördelningen inuti individuella vävnadsceller och teamet förväntar sig att detta arbete förfinas, minska och ersätta djurförsök samtidigt som forskarna får ett nytt perspektiv på läkemedelsutveckling.
Nanomediciner (NM) i form av antikroppar och syntetiska nanomaterial kan komplettera konventionell medicin med små molekyler genom aktiv vävnadsinriktning, varierande tidsramar för cirkulation och stabilitet, kopplat till justerbar biodistribution. Forskarlag är starkt beroende av djurmodeller för att kvantifiera levererade doser, väcker frågor om etik och ökningar av tid och kostnader. Ur vetenskaplig synvinkel, Destruktion av vävnadsarkitektur som utförs under vävnadshomogenisering för kvantifiering kan eliminera kritisk kunskap om nanomedicintransport inuti vävnadsceller och kärl. Ett läkemedel kan nå celler genom att uppvisa optimal plasmafarmakokinetik för att nå vävnadens kärl. Arkitekturen och nanopartikeldiametern tillåter kritisk transport av läkemedlet över mikrokärlsväggar in i en infekterad eller normal vävnadscellmiljö.
I detta arbete, Price och Gesquiere kopplade en in vitro/in silico-simuleringsmetod för att förutsäga NM-biodistribution inom prekliniska arter (djur- och cellmodeller) på nivån för den enskilda cellen. De redovisade skillnader i nanopartikelstorlek, djurarter och kärlporstorleksdiametrar med hjälp av en vätskedynamisk modell. Teamet kvantifierade cellulärt NM-innehåll i situationer där resultaten var svåra att översätta till djurstudier på grund av brist på systematiska perspektiv. De tog också upp existerande experimentella problem där celler inducerade nedbrytning av nanopartikelfluorescens för att producera falska negativ.
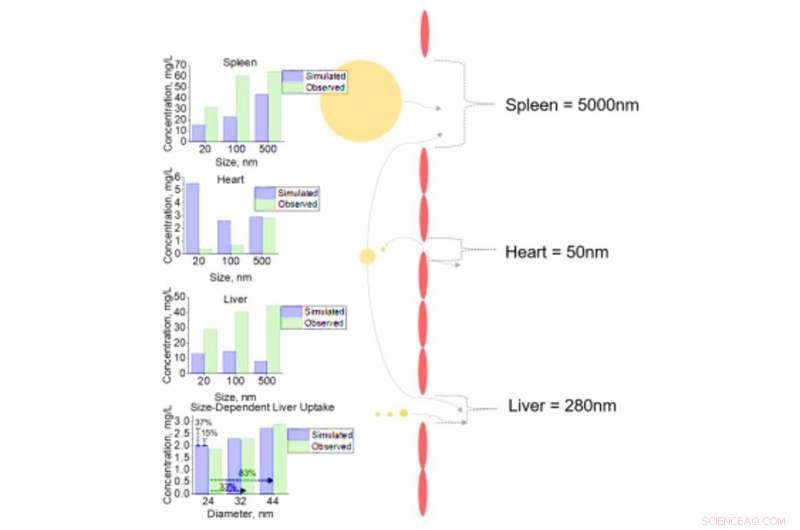
Cellanalys av NM-upptag i varierande vävnader för NM med olika diametrar. Cellulärt upptag av NM med diametrar på 20, 100, och 500nm för mjälte, hjärta, och lever med fenestrae diametrar på 5000, 50, och 280nm respektive. Känslighetsanalys av inkrementella förändringar i NM diameter (24, 32, och 44 nm) med efterföljande levercellsupptag utfördes. Alla simulerade (förutspådda) utdata jämförs med observerade data från litteraturens cellulära datamängder. Kreditera: Vetenskapens framsteg , doi:10.1126/sciadv.aax2642
För att validera deras arbete in vitro, teamet simulerade lysosomal analys kopplad till atomabsorptionsspektroskopi (AAS), och underbyggd in vivo-simuleringar genom att jämföra resultat med den publicerade litteraturen av helkroppsdjursdata för råttor, möss och icke-mänskliga primater. Forskarna använde kvantprickar (QDs) som ett modellsystem på grund av deras potential för detektion av nanopartiklar, samtidigt som man överväger deras gränser. Price et al. redogjorde för komplexiteten i en NM-plattform för att utöka kapaciteten till antikropps- och metall/polymerbaserade nanopartiklar.
När en nanopartikel cirkulerar genom djurets blodtillförsel för att komma in i vävnadsmiljön, det kommer att interagera med vävnadsceller via adsorption, desorption, internalisering eller aktiva upptagsprocesser. Forskarna exponerade nanopartiklar för icke-toxiska QDs (quantum dots) för att fluorescerande upptäcka deras interaktioner med celler som vanligtvis möts av NMs som makrofager, endotelceller och epitelceller, efter intravenös injektion. Forskargruppen kvantifierade koncentrationen av nanopartiklar som interagerar med celler in vitro och byggde cellkinetiksimuleringar för att bedöma hastighetskinetiken och NM-cellinteraktioner.
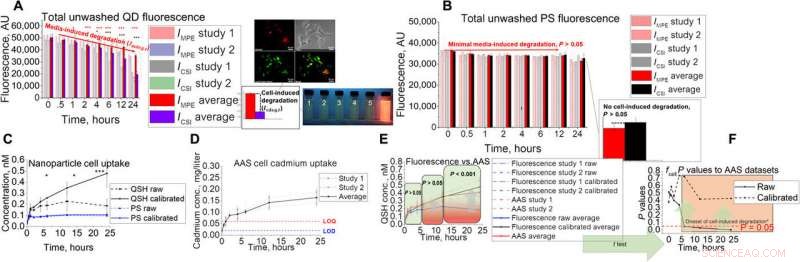
In vitro analysutveckling och validering till AAS. (A och B) In vitro-analysuppställning med dess kopplade otvättade fluorescenssignal för (A) QD och (B) PS. Bilder visar Hepa1-6-kolokalisering av QD i lysosomala fack samt ögonblicksbilder av fluorescens under ultraviolett belysning under simulerade lysosomala exponeringsförhållanden med pH 2,5, 3.0, 3,5, 4,0, 4,5, och 7,4 (1 till 6, respektive). (C till E) QD-upptagsstudier med in vitro-teknik med (C) fluorescens, (D) AAS, (E) kombinerat, och (F) statistiska resultat med tvåsidigt t-test när man jämför rått och kalibrerat fluorescensupptag med AAS-data. Asteriskerna i figuren representerar signifikans vid * (P <0,05), ** (P <0,01), och *** (P <0,001) nivåer. Kreditera: Vetenskapens framsteg , doi:10.1126/sciadv.aax2642
Simuleringen innehöll ett (i) medium, (ii) cellmembran och (iii) cellrumsavdelningar sammankopplade via grundläggande massöverföringsekvationer och första ordningens hastighetskonstanter. De optimerade systemet med hjälp av en genetisk algoritm i MATLAB och noterade att membranadsorptionshastighetskonstanten var högst för makrofager och lägst för endotel- och leverceller. Av celltyperna, internaliseringsprocessen var också relativt högst för levervävnadsceller och lägst för endotelceller. Konfokal avbildning stödde visuellt dessa data med snabbt upptag och mättnad av makrofager inom en timme efter exponering, medan epitel- och endotelvävnadsceller var ytterligare försenade.
Teamet visade närvaron av cellnedbrytningsfaktorer inom in vitro-analyser med hjälp av cellkinetiksimuleringar för att effektivt översätta in vitro-data till djurstudier. Atomadsorptionsspektroskopi (AAS) validerade resultaten av QD-upptag via fluorescensanalyser och betonade vikten av att beräkna cell- och mediuminducerad nedbrytning. Eftersom nanomediciner (NM) som finns inuti vävnader kan ackumuleras i interstitia, kärl eller inuti en mängd olika celltyper, teamet översatte in vitro cellkinetik till in silico djursimuleringar för att förklara detta. De genomförde två pilotstudier och bedömde trender i helvävnadsupptag som en funktion av storlek och kvantifierat NM-upptag på nivån för den enskilda cellen. Arkitektoniskt, varje simulering av vävnadsfack innehöll fyra underavdelningar för att representera epitelet, endotel- och makrofagceller.
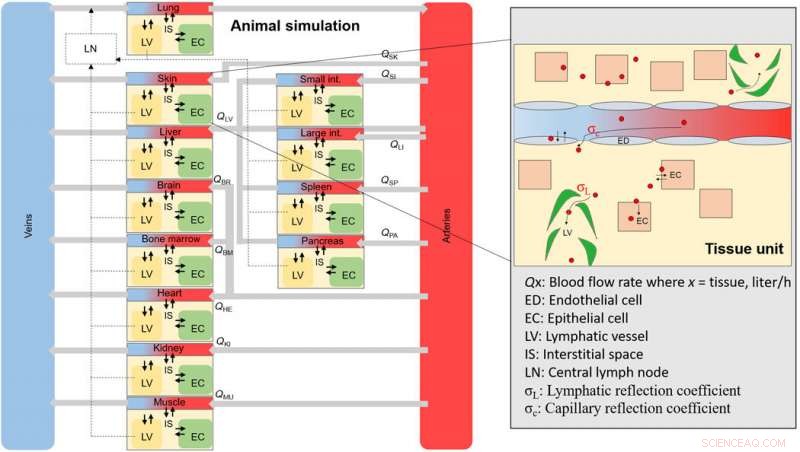
Ett övergripande schema över djur-NM-simuleringen. Schema för den övergripande vävnaden och blodfack som utgör hela djuret. Varje vävnadsfack är sammankopplat genom blodflödeshastigheter och innehåller underavdelningar (inzoomat område), där en NM kommer att distribueras vid internalisering genom endotelial fenestrae. Kreditera: Vetenskapens framsteg , doi:10.1126/sciadv.aax2642
Eftersom levern och mjälten är vanliga mål för NM-ackumulering, de använde dessa vävnader som fallstudier för att förstå och fånga, simuleringens känslighet och noggrannhet. Till exempel, Simuleringen visade att ökade NM-storlekar överskred vävnadens porstorlekar för de flesta vävnadstyper för att leda mot vävnader med större porstorlekar såsom levern. Vid denna tidpunkt, leverendotelcellerna interagerade med NM för snabb membranbindning och mättnad inom 24 timmar. När NM kom in i vävnadens interstitia interagerade det snabbt med epitelvävnadsceller (för lever) och makrofager (för mjälte). Resultaten byggde upp förtroende för simuleringens prediktiva kraft och dess förmåga att förutsäga läkemedelsinnehåll i variabel storlek på encellsnivå för djur för första gången - strikt baserat på enbart in vitro-data.
Forskarna indikerade sedan simuleringens prediktiva kraft och translationskapacitet genom att jämföra med uppmätt vävnadsnivåinnehåll för flera NM-typer och arter, inklusive råttor, möss och cellulärt innehåll (epitel, endotel och makrofag). De testade den prediktiva prestandan över flera variabler baserade på Världshälsoorganisationens riktlinjer och standarder för akademiska och farmaceutiska konsortium för läkemedelsutveckling och säkerhet. De modellförutspådda medelvärdena och de observerade medelvärdena korrelerade linjärt för att indikera rimliga modellförutsägelser för alla arter och NM-typer.
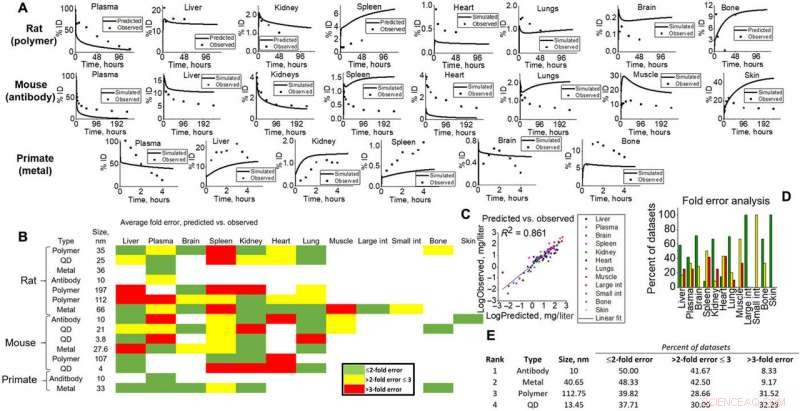
Simuleringsutgångar för validering till olika djurstudier. (A) Förutsagd vävnadsnivå (linje) kontra observerade (poäng) exempel för alla arttyper (råttor, möss, och NHP) för visuella bevis på modellkapacitet. (B) Värmekarta över veckfelsanalys beräknad för all vävnad, NM, och arttyper i simulering. Grön, gul, och rött representerar <2-faldigt, <3 gånger, och>3-faldiga fel. Vikfel beräknades enligt ekvationer som ges i Material och metoder, där simulerade datasetmedelvärden jämfördes med observerade. (C) Alla datapunktsmedelvärden specifika för vävnadstyper för simuleringar och observerade plottades mot varandra för att ge en linjär passning (R2 =0,861). (D) Vävnadsspecifika veckfel visas för att visualisera modellnoggrannhet för varje vävnad i denna studie. (E) NM-simulerade utgångar rangordnades (1 till 4) enligt analys av veckfel. Kreditera: Vetenskapens framsteg , doi:10.1126/sciadv.aax2642
På det här sättet, Edward Price och Andre J. Gesquiere utvecklade en gångbar plattform för att minska och förfina djurförsök under utveckling av nanomedicin (NM). De in vitro-koncentrerade data kopplade till cellkinetiksimuleringar gav cell-NM-interaktioner för att visa utmärkt translationspotential. Resultaten krävde inte anpassning till datauppsättningar för biodistribution av djur, eftersom alla parametrar optimerades för in vitro-data eller beräknades med hjälp av en vätskedynamisk modell. Processen fungerade även under förhållanden med NM-nedbrytning i den biologiska miljön. De kombinerade in vitro- och in silico-teknikerna kommer att hjälpa framtida smart läkemedelsdesign för att hjälpa forskare att bilda bättre och informerade diskussioner samtidigt som de minskar antalet tester på levande djur. Price och Gesquiere förväntar sig att detta arbete ska tjäna ett nytt tillvägagångssätt för prediktiva simuleringar av nanomedicintransport.
© 2020 Science X Network