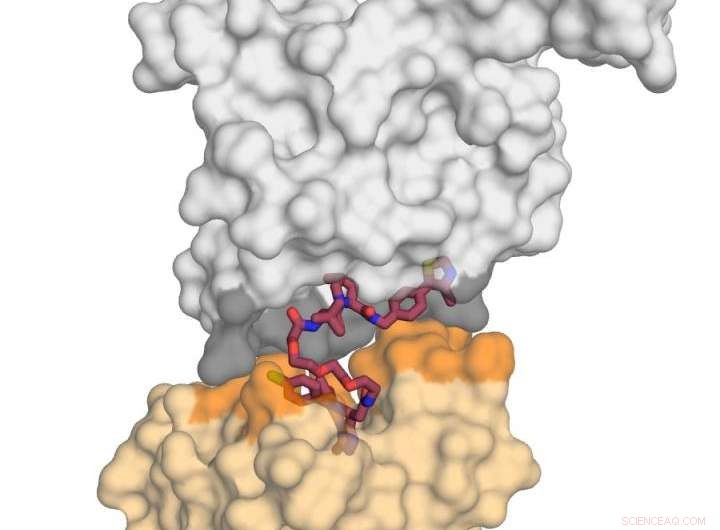
Bilden visar E3 -ligasproteinet VHL (i grått) i komplex med den lilla molekylen MZ1 (i hallon) och "kysser" proteinet BRD4 (i gult). När jag fick denna dödliga 'kyss', BRD4 är inriktad på nedbrytning. Upphovsman:Xavier Lucas, Alessio Ciulli, University of Dundee
Forskare vid University of Dundee har rapporterat ett stort genombrott när det gäller att rikta orsakerna till många sjukdomar, genom att använda en 'dödskyss' för att förstöra proteiner som tidigare hade betraktats som 'outnyttjbara'.
Mycket är känt om proteiner som Ras och Myc som är kända för att vara skyldiga till cancer hos människor, och Huntingtin, som orsakar Huntingdons sjukdom, men ännu har de visat sig envist motståndskraftiga mot ansträngningar att hitta sätt att hantera dem med droger.
Nu har forskare under ledning av professor Alessio Ciulli vid School of Life Sciences i Dundee hittat ett sätt att rikta in sig på liknande proteiner, använda en liten molekylmetod på ett okonventionellt sätt för att rikta in sig på 'dåliga' proteiner genom att binda dem till neutraliserande medel för att starta en nedbrytningsprocess, och därmed ta bort dem helt.
"Vi känner till många proteiner som är aktiva för att orsaka sjukdomar, men som vi inte har kunnat hindra från att gå `` skurk '' eller stoppa dem när de gör det, sa professor Ciulli.
"Det stora problemet är att vi inte har lyckats hitta de små molekylerna som framgångsrikt kan binda till dessa proteiner och samtidigt hindra deras funktion. Det är ett mycket komplext område - dessa proteiner kan ofta lura regulatorer i cellen och vara extremt svårt att fastställa med hämmare.
"Forskning i vårt laboratorium under de senaste åren har bidragit till att etablera ett annat tillvägagångssätt, en som har teoretiserats i många år men som först nu förverkligas helt av detta senaste arbete. Istället för att använda den lilla molekylen för att försöka inaktivera det dåliga proteinet, vi har utvecklat ett sätt att modifiera det så att det kan användas för att locka till sig de neutraliserande proteinerna, som sedan binder till sin dåliga granne och agerar mot den, startar en kaskadprocess av nedbrytning.
"Avgörande, vi har också funnit att det inte räcker med att detta neutraliserande protein sitter nära det dåliga proteinet, den måste ta direkt kontakt med den, att 'kyssa' den. Och inte bara en liten puck, men en riktig 'Gone With The Wind' omfamning. Vi kallar detta en 'dödskyss', eftersom det är nyckeln för att säkerställa nedbrytningen av det dåliga proteinet. "
Professor Ciulli och kollegor fokuserade sin uppmärksamhet på en tvåvärd kemisk nedbrytande molekyl som kallas `` PROTAC '' (Proteolysis-targeting chimeric molecules). De har kunnat skapa den första röntgenkristallstrukturen för en PROTAC bunden till både det "dåliga" proteinet och det "neutraliserande" medlet (ett E3 ubiquitinligas), och fann att det framgångsrikt kan användas som en "magnet" för att dra de två målproteinerna tillsammans.
"Denna upptäckt ger den första insikten någonsin om hur PROTAC fungerar och hur vi kan rikta proteiner för nedbrytning på ett mycket selektivt sätt, sa professor Ciulli.
"Detta presenterar ett paradigmskifte i hur vi kan säkerställa selektiv kemisk intervention mot proteiner som vi vet är faktorer som orsakar sjukdom men som hittills har varit omöjliga att rikta in sig på. Det pekar mot möjligheten att droga det" outnyttjbara "."
Resultaten av forskningen publiceras i tidskriften Natur kemisk biologi .
Dundee -teamets arbete fokuserade på att para ihop ett av BET -bromodomainproteinerna, BRD4, vilket är ett attraktivt läkemedelsmål för cancer, med en selektiv BRD4 'degrader' kallad MZ1. De fann att MZ1 kunde dra ihop de två proteinerna genom att vika in i sig själv. När de två proteinerna är sammanfogade i sin "kyss" leder interaktionerna mellan dem till nedbrytning av målet. De visade hur liknande proteiner BRD2 och BRD3 inte heller kysser det neutraliserande proteinet, och guidade av denna information kunde de designa nya nedbrytare som helt undviker dessa proteiner från nedbrytningsprocessen. Detta är viktigt eftersom det belyser hur nedbrytande molekyler kan utformas i framtiden för att minimera effekter utanför målet på sätt som kanske inte är möjliga med konventionella hämmare.
Dundee -teamet som arbetade med projektet inkluderade postdoktorala forskare i professor Ciullis laboratorium Morgan Gadd, Andrea Testa, Xavier Lucas och Kwok-Ho Chan, och Wengzhan Chan och Dougie Lamont från Dundee Fingerprints Proteomics Facility.
Professor Ciulli sa att det redan fanns lovande tecken från läkemedelsindustrin på betydande investeringar inom detta forskningsområde.
"Vi förstår nu bättre hur man gör hämmare till nedbrytare. Vägen till att göra nedbrytare till läkemedel kommer att bli lång och slingrande och vi kan inte komma dit på egen hand. Det är spännande att se tecken på seriöst engagemang från läkemedelsindustrin, vilket ökar optimismen för att vi kommer att kunna nå en punkt där vi kan droga det 'outnyttjbara'. "