Kemisk energi härstammar i växelverkan mellan atomer och molekyler. Generellt är det en omlagring av elektroner och protoner, som kallas en kemisk reaktion, som producerar elektriska laddningar. Energibesparingslagen föreskriver att energi kan omvandlas eller omvandlas men aldrig förstörs. Därför bidrar en kemisk reaktion som minskar energin i ett system den energi som förloras till miljön, vanligtvis som värme eller ljus. Alternativt kan en kemisk reaktion som ökar energin i ett system ha tagit denna extra energi från miljön.
Organiska reaktioner
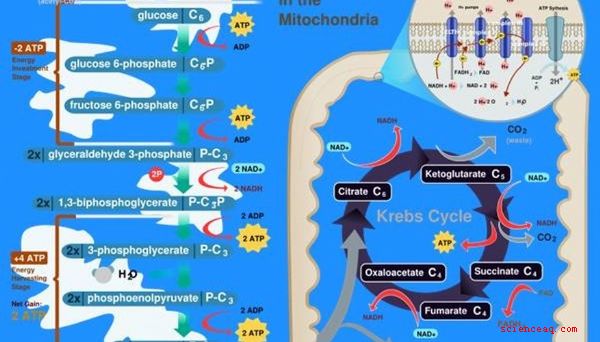
Biologiskt liv beror på kemisk energi. De två vanligaste källorna till biologisk kemisk energi är fotosyntes hos växter och andning hos djur. I fotosyntes använder plantor ett speciellt pigment som kallas klorofyll för att separera vatten i väte och syre. Vätet kombineras sedan med kol från miljön för att producera kolhydratmolekyler som växten kan använda som energi. Cell respiration är den omvända processen, med hjälp av syre för att oxidera eller bränna en kolhydratmolekyl såsom glukos i en energibärande molekyl som heter ATP, som kan användas av enskilda celler.
Oorganiska reaktioner
Även om det kanske inte verkar uppenbart först, är förbränning som förekommer i gasdrivna motorer en biologisk kemisk reaktion som använder syre i luften för att bränna bränsle och driva en vevaxel. Bensin är ett fossilt bränsle härrörande från organiska föreningar. Men inte all kemisk energi är naturligtvis biologisk. Varje ändring i kemiska bindningar i en molekyl innebär överföring av kemisk energi. Förbränning av fosfor i slutet av en matchstick är en kemisk reaktion som producerar kemisk energi i form av ljus och värme genom att använda värme från slaget för att initiera processen och syre från luften för att fortsätta brinna. Den kemiska energi som produceras av en aktiverad glödstift är mestadels lätt med mycket liten värme.
Reaktionshastighet
Oorganiska kemiska reaktioner används också ofta för att syntetisera önskade produkter eller minska oönskade. Utbudet av kemiska reaktioner som producerar kemisk energi är ganska stor, allt från enkel omorganisation av en enda molekyl eller en enkel kombination av två molekyler, till komplexa interaktioner med flera föreningar med olika pH-nivåer. Hastigheten för en kemisk reaktion beror vanligtvis på koncentrationen av reaktantmaterialen, ytan som är tillgänglig mellan dessa reaktanter, temperaturen och trycket i systemet. En given reaktion kommer att ha en regelbunden hastighet med tanke på dessa variabler, och kan kontrolleras av ingenjörer som manipulerar dessa faktorer.
Katalysatorer
I vissa fall krävs närvaro av en katalysator för att starta en reaktion eller att skapa en signifikant reaktionshastighet. Eftersom katalysatorn inte själv förändras i reaktionen kan den användas om och om igen. Ett vanligt exempel är katalysatorn i ett bilutblåsningssystem. Närvaron av platinagruppmetaller och andra katalysatorer reducerar skadliga ämnen till mer godartade ämnen. Typiska reaktioner i en katalysator är reduktion av kväveoxider till kväve och syre, oxidation av kolmonoxid till koldioxid och oxidation av oförbrända kolväten till koldioxid och vatten.