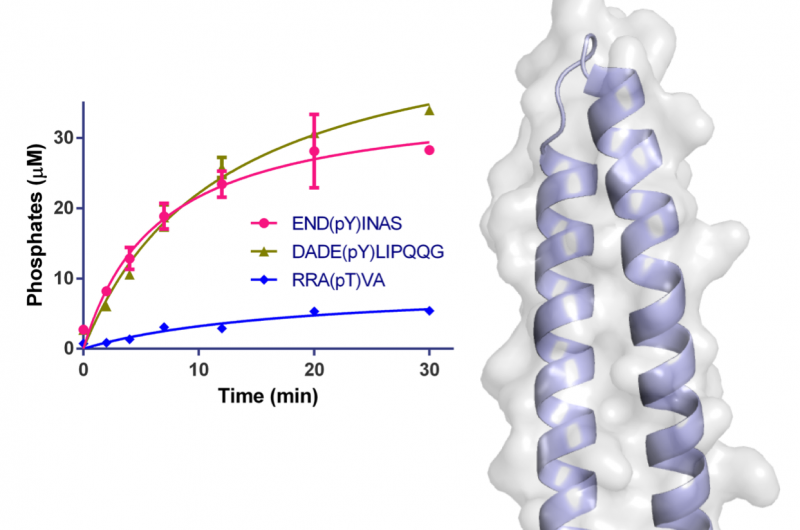
Figur 1:Struktur för WipA i tecknad film och halvtransparent ytrepresentation. Fosfatasdomänen representeras i rödgrön och den bifogade spiralspolen i ljusblått. Rester involverade i katalys representeras som stickor runt Mn2+ och fosfatjonerna. Ytan visas i ljusgrått. Den infällda grafen visar tidsförloppets fosforylering av specifika peptider med 20 nM WipA. Upphovsman:Diamond Light Source
Londonbaserade forskare har klargjort strukturen för ett stort fragment av ett bakteriellt protein, känd som WipA, som utsöndras av Legionella pneumophila. Arbetet, nyligen publicerad i Journal of Biological Chemistry , visade att proteinet hade några fascinerande egenskaper som gav värdefull insikt i dess verkningsmekanism.
Bakterien, L. pneumophila, orsakar en allvarlig form av lunginflammation som kallas legionärsjukdom. Patogeniteten hos denna bakterie beror på utsöndringen av över 300 effektorproteiner i värden. En sådan effektor, WipA, uppmärksammades för sitt beroende av ett chaperon -komplex (behövs för att säkerställa proteinfunktionalitet) för dess utsöndring och dess okända roll i patogenicitet.
Två av makromolekylär kristallografi (MX) strålningslinjer (I02 och I04) vid Diamond Light Source användes för att initiera studien och lösa kristallstrukturen för ett stort fragment av WipA. Strukturen visade att proteinet innehöll en serin/treoninfosfatasveck som överraskande riktade mot tyrosinfosforylerade peptider. Dessutom, det antogs att WipA kunde övergå från ett homodimeriskt tillstånd till ett hetero-dimeriskt tillstånd för att interagera med ett tyrosin-fosforylerat värdmål. Upptäckterna hjälper till att klargöra de molekylära mekanismerna som ligger till grund för Legionellapatogenicitet och kan hjälpa utvecklingen av hämmare.
Infekterad ånga
Legionärsjukdom kan vara dödlig bland utsatta medlemmar i en befolkning, och är särskilt farligt vid sjukhusutbrott. En av de viktigaste källorna till Legionella-infektion är från vattenånga i luftkonditioneringssystem, pannor, varma bad och duschar.
När en värd andas in den infekterade ångan, bakterierna kommer in i lungorna och söker upp vita blodkroppar, kallas makrofager. Bakterierna blir uppslukade av makrofagerna, men istället för att dödas av dem, bakterierna använder smart ett sekretionssystem av typ IVb för att utsöndra ett stort antal effektorproteiner i värdcellen för att höja värdens cellulära maskiner och säkerställa bakteriell överlevnad.
Omfattande screening
Det huvudsakliga fragmentet av WipA kristalliserades framgångsrikt genom att ta bort båda ändarna av sekvensen som förutsade ostrukturerade regioner. Kristallerna analyserades initialt vid Diamond's I02 och I04 beamlines, medan arbetet slutfördes vid PetraIII P13 -strållinjen vid European Molecular Biology Laboratory i Hamburg.
På Diamond, Microfocus MX beamline (I04) användes för kristallscreening och I02 användes för att samla in diffraktionsdata. Dr Nikos Pinotsis är postdoktoral forskare i struktur- och molekylärbiologi vid professor Gabriel Waksmans laboratorium vid Institute of Struktur- och molekylärbiologi vid Birkbeck/UCL och medforskare av studien. Han förklarade deras tillvägagångssätt, "Även om storleken på WipA -kristallerna var tillräcklig för enkristall -diffraktionsförsök, de flesta av dem visade flera och/eller störda galler, därför var omfattande screening avgörande för att framgångsrikt skaffa data med hög upplösning och kvalitet. Vi optimerade våra datainsamlingsstrategier till en strålstorlek som passade tillräckligt med kristallens dimensioner och optimerade strålen genom att maximera strålen och exponeringstiden samtidigt som strålskador minimerades. "
Första i sin klass
Strukturen för WipA -fragmentet uppvisade en fosfatasveck monterad på en spiralformad hårnål, som var den första i sin klass. Kärnan i denna struktur liknade ett serin/treoninproteinfosfatas, men biokemiska experiment visade oväntat att det hade en preferens för tyrosinfosforylerade substrat. Denna överraskande observation hade bara noterats en gång tidigare bland flera hundra liknande fosfataser.
Dr Pinotsis förklarade relevansen av resultaten:"När värdmålet för defosforylering av WipA är känt, hämmare kan utformas för att hämma den interaktionen. Även om det är möjligt att dessa fynd kan leda till utformningen av antibakteriella medel, de bidrar mest till en allmän förståelse för en bakteries överlevnad och patogenicitet, vilket är ett mycket viktigt första steg för att etablera långvariga behandlingar mot infektioner. "
Teamet planerar att identifiera WipA-målet i värdceller och kommer att fortsätta att utforska ytterligare protein-protein-interaktioner för att ge en mer fullständig bild av infektionsmekanismen för Legionella.