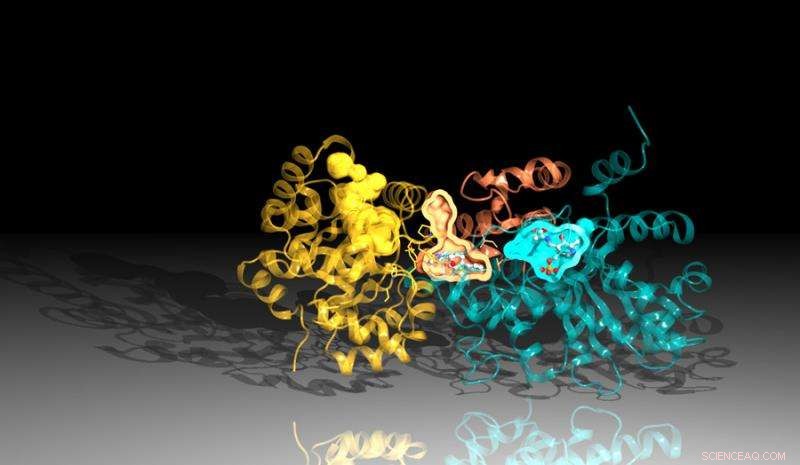
Bild på proteinet tryptofansyntas skapat med diffraktionsdata från Argonnes Advanced Photon Source. Inhibitorn binder mellan reaktionsställena i proteinet, representeras här av de orange och blå fickorna. Upphovsman:Argonne National Laboratory
Tuberkulos har nu överträffat hiv världen över som den ledande dödsorsaken på grund av infektionssjukdom. Bakterierna som orsakar denna sjukdom, Mycobacterium tuberculosis (Mtb), utvecklar snabbt resistens mot för närvarande tillgängliga antibiotika, öka brådskan för att upptäcka nya läkemedel.
Forskare vid US Department of Energy's (DOE) Argonne National Laboratory var en del av en ny upptäckt av en ny molekyl som kallas en hämmare som attackerar tuberkulosframkallande bakterier genom att avbryta produktionen av en kemikalie som är nödvändig för dess överlevnad.
Att skapa antibiotika innebär att man utvecklar hämmare som effektivt kan blockera väsentliga bakteriella processer. Lika viktigt är att fortsätta hitta nya vägar att rikta in sig på så att när bakterierna så småningom anpassar sig för att motstå ett antibiotikum, det finns fortfarande andra vägar att utnyttja.
Den nya studien, ett samarbete mellan Argonne, University of Chicago och Broad Institute of Harvard och MIT, identifierade en hämmare som verkar genom att blockera verkan av ett viktigt protein i Mtb. Inhibitorn binder till en kanal i proteinet som förbinder dess två delar, dödar bakterierna genom en ironisk twist. Inhibitorn tvingar en del av proteinet att producera de komponenter som är nödvändiga för att skapa en väsentlig kemikalie, tryptofan, samtidigt som kanalen omformas för att fånga upp dessa ingredienser innan den andra delen av proteinet kan använda dem.
Dessa typer av hämmare, kallas allosteriska hämmare, binder inte till den del av proteinet som faktiskt ansvarar för att producera målkemikalien. Istället, de fungerar som en apnyckel som fastnat i andra mindre uppenbara delar av bakteriens komplicerade maskineri. Hämmaren som identifierats i denna forskning, beskrivs i en nyligen publicerad artikel i Nature Chemical Biology, är nu en av de mest djupt studerade allosteriska hämmarna hittills.
Den riktade kemikalien, tryptofan, är en substans som är avgörande för att ge alla levande celler sin struktur och skydda dem från sin omgivning. Mänskliga celler måste rota tryptofan från mat eller bakterier i tarmen, men Mtb -celler kan tillverka sin egen tryptofan med hjälp av ett komplext protein som kallas tryptofansyntas. "Vi visste att ett sätt att döda dessa bakterier var att hitta ett sätt att blockera tryptofansyntas, "sa Karolina Michalska, en Argonne -kristallograf och författare till studien.
Innan samarbetet började, en grupp forskare vid Broad Institute lade en liten mängd bakterier i petriskålar och placerade olika potentiella hämmare i var och en. Från ett bibliotek med över 80, 000 testade potentiella hämmare, bara ett fåtal dödade Mtb. Forskarna misstänkte att en av dessa hämmare stängde av Mtb:s tryptofansyntas, men de behövde se vad som hände på molekylär nivå.
Argonne -forskare hörde om arbetet vid Broad Institute, och de två grupperna började samarbeta. Argonne producerade tryptofansyntas för Broad Institute att använda för att testa hämmaren. De bestämde också syntasens struktur med hämmaren bunden till den genom att exponera kristaller sammansatta av proteinhämmarkomplexet för högenergiröntgenstrålar från Argonnes Advanced Photon Source (APS) och registrera hur elektronerna i molekylen sprider ljuset .
"Samarbetet gjorde det möjligt för oss att bestämma inhibitorens allosteriska natur och nyanser av hur hämningen fungerade, "sa Deborah Hung, en professor vid Harvard Medical School och meddirektör för programmet för infektionssjukdomar och mikrobiomer vid Broad Institute.
Strukturanalysen fastställde att det finns två viktiga delar som utgör tryptofansyntas. När en av regionerna signalerar till den andra att den är klar, den andra regionen gör en kemisk substans som kallas indol. Indolen färdas sedan genom en kanal till den andra regionen av tryptofansyntaset där den kombineras med en annan substans för att skapa den slutliga produkten, tryptofan.
En liten instabilitet i kanalen skulle tillåta indolen att resa till andra sidan, men hämmaren är formad så att den stabiliserar kanalen, förhindrar att indolen rör sig. Eftersom indolen inte kan nå proteinets bortre sida, hämmaren blockerar produktionen av tryptofan.
"Det fungerar faktiskt på ett lurigt sätt, "sa Andrzej Joachimiak, Direktör för Argonnes strukturbiologiska centrum och Midwest Center for Structural Genomics. "Inhibitorn tvingar både tryptofansyntaset att producera indolen och hindrar den från att utföra sin yttersta plikt."
Även om forskare är optimistiska om denna hämmares potential som antibiotikum, det är fortfarande långt ifrån att vara ett tillgängligt läkemedel. De har studerat hur mänsklig vävnad skulle reagera på molekylen och har bekräftat att den är giftfri, men experiment med möss har visat att hämmaren skulle metaboliseras av kroppen för snabbt. Forskning görs nu för att förfina hämmarens struktur så att den kvarstår i blodomloppet under en längre tid.