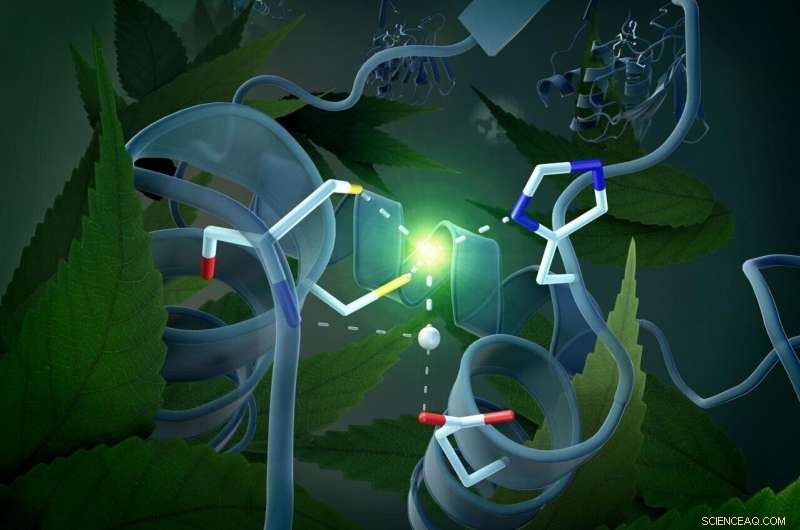
Runt det katalytiska centret finns en grupp molekyler, gatingdomänen, som kan inta två olika positioner. Kredit:M. Künsting / HZB
Alla växtceller får sin energi huvudsakligen från två organeller de innehåller - kloroplaster (ansvariga för fotosyntes) och mitokondrier (ansvariga för den biokemiska andningscykeln som omvandlar socker till energi). Dock, ett stort antal av en växtcells gener i dess mitokondrier och kloroplaster kan utveckla defekter, äventyrar deras funktion. Ändå, växtceller utvecklade ett fantastiskt verktyg som kallas RNA-editosomen (ett stort proteinkomplex) för att reparera dessa typer av fel. Det kan modifiera defekt budbärar-RNA som är ett resultat av defekt DNA genom att transformera (deaminering) av vissa mRNA-nukleotider.
Automatisk felkorrigering i växtceller
Automatisk felkorrigering i växter upptäcktes för cirka 30 år sedan av ett team under ledning av växtfysiologen Axel Brennicke och två andra grupper samtidigt. Denna mekanism omvandlar vissa cytidinnukleotider i budbärar-RNA:t till uridin för att korrigera fel i kloroplast-DNA eller mitokondrie-DNA. RNA-redigering är därför väsentlig för processer som fotosyntes och cellandning i växter. År senare, ytterligare studier visade att en grupp proteiner som kallas PPR-proteiner med DYW-domäner spelar en central roll i växt-RNA-redigering. Dessa PPR-proteiner med DYW-domäner transkriberas i cellkärnan och migrerar genom cellerna till kloroplaster och mitokondrier. Dock, de är inaktiva på väg till dessa organeller. Först när de är inom organellerna blir de aktiva och utför sin funktion på ett specifikt mRNA-ställe. Hur denna aktivering fungerar, dock, har varit ett mysterium fram till nu.
Det fungerar inte i ett provrör
Under många år, det var inte möjligt att syntetiskt producera dessa PPR-proteiner av DYW-typ i laboratoriet för att närmare studera deras funktion och struktur. Först nu har ett tysk-japanskt team under ledning av strukturbiologen och biokemisten Dr Gert Weber från Joint Protein Crystallography Group vid Helmholtz-Zentrum Berlin och Freie Universität Berlin lyckats göra det.
Nu:3D-struktur av nyckelproteinet avkodat
Prof. Mizuki Takenakas grupp hade tidigare kunnat producera DYW-domänen i bakterier. Takenaka har forskat vid Kyoto University sedan 2018 och har tidigare arbetat i Axel Brennickes laboratorium i Ulm, Tyskland. Tatiana Barthel (University of Greifswald och nu vid HZB) kunde sedan odla de första proteinkristallerna i DYW-domänen. Ett stort antal av dessa ömtåliga kristaller har nu analyserats vid MX-strållinjerna i BESSY II så att den tredimensionella arkitekturen för DYW-domänen kunde avkodas. "Tack vare den gemensamma forskningsgruppen som är samlokaliserad vid HZB och FU Berlin, vi har förmågan till stråltid för mätningar mycket snabbt när det behövs, vilket var avgörande, " säger Dr. Manfred Weiss, som är ansvarig för MX-strållinjerna vid BESSY II och medförfattare till studien.
Aktiveringsmekanism upptäckt
Denna tredimensionella arkitektur har faktiskt gett den avgörande ledtråden till mekanismen för DYW-domänaktivering som gäller för alla växter. Det beror på en zinkatom som ligger i mitten av DYW-domänen som kan påskynda deamineringen av cytidin till uridin som en katalysator. För att detta ska hända, dock, zinken måste vara optimalt placerad. Aktiveringsomkopplaren tillhandahålls av en mycket ovanlig grinddomän i omedelbar närhet av det katalytiska centret – den strukturella analysen visar att denna grinddomän kan anta två olika positioner, därigenom slå på eller av enzymet. "Rörelsen av gatingdomänen reglerar i vilken utsträckning zinkjonen är tillgänglig för den katalytiska reaktionen, " förklarar Weber.
En molekyl som en sax
Nu har det blivit tydligt varför det hittills varit svårt att få PPR-proteiner av DYW-typ att reagera med RNA i provröret:Dessa PPR-proteiner är nominellt inaktiva och kräver aktivering. I växtcellerna, de produceras först i cellkärnan och vandrar sedan med stor sannolikhet i ett inaktiverat tillstånd till organellerna, där de aktiveras. "Det här är idealiskt, för annars skulle dessa molekyler vara aktiva längs vägen, förändra olika RNA-molekyler på ett okontrollerat sätt som är skadligt för cellen, säger Weber.
Universal reparationsverktyg
Detta arbete är ett genombrott för växtmolekylärbiologi eftersom det beskriver en ytterligare nivå av sofistikerad reglering i kloroplaster och mitokondrier. Resultaten är grundläggande för växtvetenskap, men de kan också spela en roll i vårt dagliga liv en dag. DYW-domänen kan vara ett användbart verktyg för kontrollerbar och platsspecifik C-till-U och U-till-C RNA-redigering. Detta kan öppna upp för nya bioteknik- och medicinska tillämpningar, som att omprogrammera vissa mitokondriella gener utan att ändra en cells kärn-DNA.