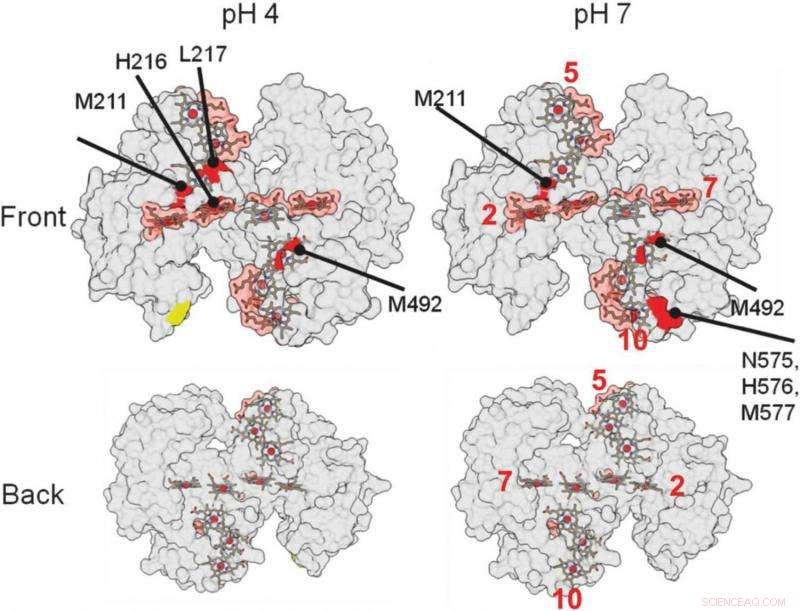
ut på dessa 3-D strukturella renderingar av proteinet, hjälpte forskare att identifiera var proteinet binder med ett mineral. De röda områdena indikerar möjliga bindningsområden. Kredit:Berkeley Lab
Forskare har upptäckt detaljerna i en okonventionell koppling mellan ett bakteriellt protein och ett mineral som gör att bakterien kan andas när syre inte är tillgängligt.
Forskningen, utförd av ett team av forskare vid Department of Energy's Lawrence Berkeley National Laboratory (Berkeley Lab), kan leda till nya innovationer när det gäller att koppla proteiner till andra material för biobaserade elektroniska enheter – till exempel sensorer som kan diagnostisera sjukdomar eller upptäcka föroreningar. Det kan också hjälpa forskare att förstå och kontrollera de kemiska reaktionerna som orsakas av dessa protein-materialinteraktioner.
"Att flytta elektroner till metaller kan få olika mineraler att växa eller lösas upp. Att studera hur ett protein gör detta kan hjälpa oss att förstå både hur organismer omskapar sin miljö och gör biomineraler för tänder eller skydd, sa Caroline Ajo-Franklin, en personalvetare i Biological Nanostructures Facility vid Berkeley Labs Molecular Foundry, som är ett forskningscenter för nanovetenskap.
Ajo-Franklin ledde studien, publicerad online i Journal of the American Chemical Society Tidigare den här månaden.
"Att förstå hur dessa interaktioner mellan proteiner och material ser ut kan hjälpa oss att designa dem bättre, " tillade hon, "och ge oss insikt om hur man kopplar samman levande celler med enheter."
Forskare förlitade sig på en röntgenbaserad teknik vid Berkeley Labs Advanced Light Source (ALS), känd som "fotavtryck, " för att lokalisera de kemiska kopplingarna mellan bakterieproteinet och nanopartiklar som består av järn och syre.
Studien, som identifierade en förvånansvärt liten och svag bindningsplats, också dragit nytta av verktyg och expertis på Lab's Molecular Foundry; och det Lab-ledda Joint BioEnergy Institute, som specialiserat sig på forskning om biobränslen.
Strukturen av detta exotiska protein hade tidigare kartlagts isolerat med detaljer i atomskala av andra forskargrupper med hjälp av röntgenkristallografi, vilket krävde en kristalliserad form av proteinet. Men forskare visste inte hur det band till det metallinnehållande mineralet-konventionella tekniker kan inte se denna bindningsprocess.

Sayan Gupta, en expert på röntgenavtryck, visar en typ av provhållare som användes för att studera hur ett protein binder till ett mineral. Kredit:Paul Mueller
Under 2014, Ajo-Franklin lärde sig av Corie Ralston, en annan labbforskare som arbetar inom avdelningen Molecular Biophysics and Integrated Bioimaging (MBIB), om röntgenmasspektrometrins fotavtrycksteknik, ett innovativt sätt att exakt undersöka proteiner och deras omgivning med röntgenstrålar vid ALS.
Ajo-Franklin och Ralston drev båda separata laboratoriestyrda forsknings- och utvecklingsprojekt, och de såg att de två ansträngningarna faktiskt kunde komplettera varandra.
Ralston hade antagit röntgenfotavtryckstekniken från sin tidigare rådgivare, Mark Chance, en professor vid Case Western Reserve University som etablerade röntgenfotavtryckstekniken vid Brookhaven National Laboratory på Long Island, N.Y. Denna röntgenteknik är endast tillgänglig på ALS och Brookhaven's National Synchrotron Light Source II (NSLS-II).
"Fotavtryck kan berätta hur proteiner interagerar, "Ralston sa. "Det kan ge strukturell och dynamisk information om proteiner i nära deras naturliga miljö."
Proteinet som valts ut för studien är från en metallreducerande bakterie, Shewanella oneidensis, som "äter socker och i princip andas mineraler" när syre inte är tillgängligt, Ajo-Franklin noterade. "En av anledningarna till att dessa organismer är så roliga att studera är att de interagerar med ett brett utbud av material."
Efter Tatsuya Fukushima, en tidigare labforskare som var medförfattare till studien, hittat ett lämpligt sätt att förbereda proteinet och nanopartiklarna i en flytande lösning för röntgenstudier, Sayan Gupta, en röntgenexpert i Berkeley Labs MBIB-division, använde en röntgenstrållinje vid ALS för att studera proverna.
"Vi fångar ögonblicksbilder av tillståndet för denna molekyl vid en viss tidpunkt, "Gupta sa." Det är en enkel teknik och ger dig massor av information om ett proteins ursprungliga tillstånd. "
I denna teknik, Röntgenstrålar producerar mycket reaktiva molekyler som kallas hydroxylradikaler när de passerar genom den flytande lösningen som omger proteinet. Dessa radikaler modifierar proteinet på ett sätt som gör det möjligt för forskare att identifiera små kemiska variationer där proteinet är i kontakt med lösningen.
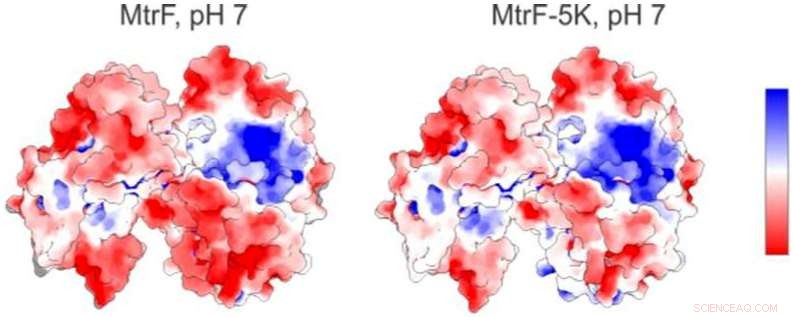
En elektrostatisk karta (vänster) över ett protein som studerats vid Berkeley Labs avancerade ljuskälla visar positivt laddade (blå) och negativt laddade (röda) regioner. Till höger är en förutsagd elektrostatisk karta för en mutant form av proteinet. Kredit:Berkeley Lab
De regioner av proteinet som interagerar med andra proteiner eller material är skyddade från radikalerna och inte föremål för de kemiska förändringarna. De platser där proteinet inte förändras indikerar var bindningen sker.
I den senaste studien, dessa kemiska ögonblicksbilder producerade med röntgenfotavtryckstekniken vid olika tidpunkter analyserades därefter med en teknik som kallas masspektrometri vid Joint BioEnergy Institute.
En detaljerad analys av Fukushima avslöjade hur proteinet kopplade till mineralet.
"Det största fyndet, det var ganska förvånande, var att våra proteiner binder relativt svagt, "Ajo-Franklin sa. "De flesta proteiner som gränsar till material binder väldigt hårt, " ändrar form när de bildar denna koppling. Detta speciella protein verkar inte ändra form alls och interagerar bara med mineralet på ett litet område, kräver cirka fem gånger mindre bindningsenergi, i jämförelse, än typiska proteiner som bildar biomineraler.
Det är faktiskt väldigt meningsfullt, tillade hon. "Det här proteinets uppgift är att överföra elektroner till mineralet, så det behöver inte vara i kontakt särskilt länge."
Forskargruppen arbetar nu med att studera hur detta och liknande proteiner interagerar med en rad mineraler.
"Det finns ett gäng proteiner i den här familjen, ", sade Ajo - Franklin. "Vi är verkligen exalterade över att se hur dessa proteiner interagerar med olika material. Använder de alla samma bindande strategi? "
Denna studie ger redan idéer om hur man kan designa om dessa proteiner för att skapa bättre elektroniska anslutningar och därmed känsligare bioelektroniska sensorer – ett projekt som Ajo-Franklin arbetar med.