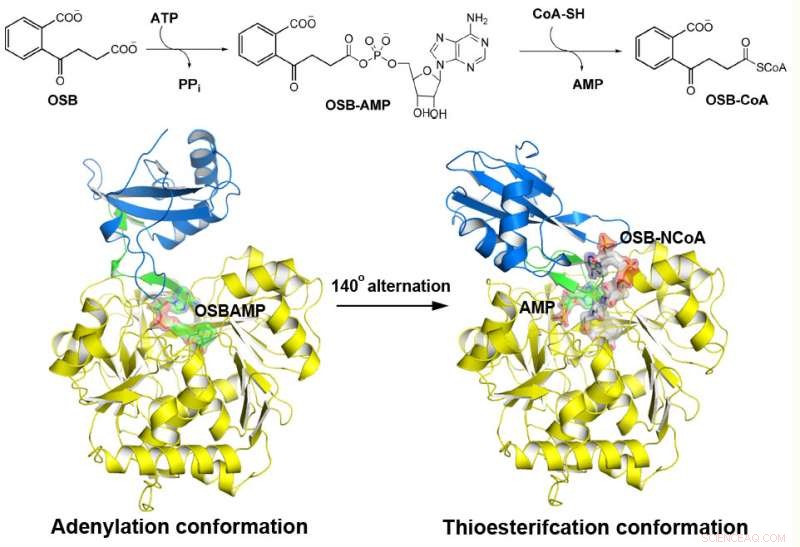
MenE katalyserar en tvåstegsreaktion i två olika strukturer. Kredit:Institutionen för kemi, HKUST
o-Succinylbenzoyl-CoA (OSB-CoA) syntetas (MenE) är ett viktigt enzym i bakteriell vitamin K-biosyntes och ett viktigt mål i utvecklingen av nya antibiotika. Det är medlem i adenyleringsenzymer (ANL) -familjen, som omkonfigurerar sin aktiva plats i två olika aktiva konformationer, den ena för adenyleringshalvreaktionen och den andra för en tioesterifieringshalvereaktion, i en katalytisk mekanism för domänalternation. Även om flera aspekter av adenyleringsmekanismen i MenE nyligen har avslöjats, dess tioförestringskonformation förblir svårfångad.
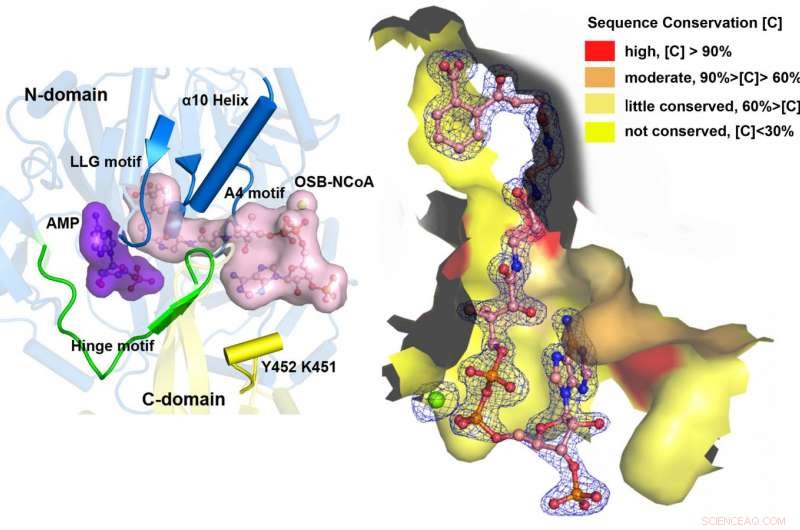
Med hjälp av ett katalytiskt kompetent Bacillus subtilis-mutantprotein komplexerat med en OSB-CoA-analog, forskare från Hong Kong University of Science and Technology avslöjade en tioesterifieringsaktiv plats specifikt konserverad bland MenE-ortologer och ett substratbindande läge som skiljer sig från många andra acyl/aryl-CoA-syntetaser. Flera rester som specifikt bidrar till tioförestringens halvreaktion utan att påverka adenyleringens halvreaktion identifierades, och de observerade också en väsentlig förflyttning av den aktiverade succinylgruppen i tioförestringens halvreaktion.
Deras resultat publicerades i Journal of Biological Chemistry den 21 juli, 2017.
"Våra fynd ger nya insikter om domänalternationskatalysen av ett bakteriellt enzym som är viktigt för biosyntes av K-vitamin, och dess adenylerande homologer i ANL -enzymfamiljen, "sa Zhihong Guo, docent vid Institutionen för kemi i HKUST. "Vårt arbete validerade hypotesen att ett distinkt substratbindande läge är unikt för detta enzym."
MenE katalyserar en tvåstegsreaktion i två olika strukturer. Kredit:Institutionen för kemi, HKUST
Som medlem i ANL -enzymfamiljen, OSB-CoA-syntetas (MenE) är ett värdefullt läkemedelsmål i den biosyntetiska vägen för vitamin K, men lite är känt om enzymets struktur än.
"Vi har konstruerat högupplösta kristallstrukturer av en katalytiskt kompetent dubbelmutant (IRAK) av bsMenE i komplex med en stabil produktanalog, OSB-NCoA, och en kombination av OSB-NCoA och AMP, "sa Guo." Dessutom, dessa kristallstrukturer avslöjade aminosyraresterna som bidrar till igenkänning och bindning av substraten och produkterna i tioförestringsreaktionen. Dessa resultat har inte bara gett ett entydigt stöd för den katalytiska mekanismen för ANL-enzymer i allmänhet; de har också avslöjat det unika tioesterifieringsaktiva stället för OSB-CoA-syntetaser och tillhandahållit den strukturella grunden för deras katalys av tioförestringsreaktionen för att underlätta deras användbarhet som läkemedelsmål. "
"Våra fynd ger ny inblick i domänväxlingsmekanismen för det viktiga vitamin K-biosyntetiska enzymet och dess homologer i ANL-enzymfamiljen, och kommer att hjälpa oss att bygga en proteinkatalytisk cykel på ett kontinuerligt sätt, som ingen har gjort förut. "