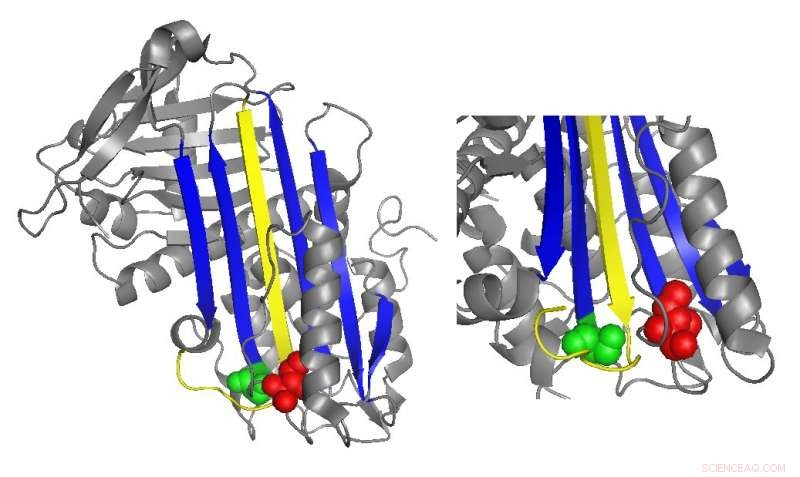
Ett banddiagram av antitrombin belyser platser för funktionellt viktiga mutationer. Kredit:Irene Martinez-Martinez
När en person skadas, blodpropp är viktigt. Dock, när faran har passerat, det är lika viktigt att stoppa koaguleringsresponsen för att förhindra trombos, eller obstruktion av blodflödet av blodproppar. Ett protein som kallas antitrombin är ansvarigt för att stoppa koagulation, men ungefär en av två tusen människor har en ärftlig brist på antitrombin som gör att de löper mycket högre risk för livshotande blodproppar.
En grupp forskare i Spanien har analyserat mutationerna i antitrombinproteinerna hos dessa patienter och upptäckt att en del av proteinet spelar en oväntad roll i dess funktion. Denna insikt om hur antitrombin fungerar kan leda till behandlingar inte bara för patienter med antitrombinbrist, men också till bättre utformade läkemedel för andra blodsjukdomar. Forskningen kommer att publiceras i numret den 6 oktober av Journal of Biological Chemistry .
Centro Regional de Hemodonacion och Hospital Universitario Morales Meseguer vid Universidad de Murcia i Spanien är ett referenscentrum för diagnos av antitrombinbrist. I över 15 år, forskare vid laboratoriet har fått prover från patienter med olika mutationer som påverkar hur deras antitrombin fungerar.
Antitrombin hämmar normalt trombin genom att infoga en ögleformad region, kallas den reaktiva mittslingan, in i det aktiva stället för trombinproteinet, förhindrar trombin från att katalysera koagelbildning genom att förvränga formen på trombinets aktiva plats. Många antitrombinmutationer som orsakar koaguleringssjukdomar påverkar direkt eller indirekt den reaktiva mittslingan. Dock, biokemiska studier ledda av Irene Martinez-Martinez upptäckte att mutationer i en helt annan del av antitrombinet också bidrog till dess dysfunktion.
"Vi såg att vi [hade] mutanter som påverkade proteinets funktion även om de var väldigt långt från huvuddelen av proteinet som ansvarar för hämningen, ", sa Martinez-Martinez. "Folk trodde att antitrombinfunktionen främst var fokuserad på en domän av proteinet. Med detta arbete, vi har insett att det inte är sant."
Forskarnas analyser av de nya mutationerna antydde att domänen av antitrombinet i den motsatta änden av den reaktiva mittslingan hjälper till att hålla trombinet fångat i dess slutliga, förvrängd form. När det fanns specifika mutationer i denna region, trombinet kunde oftare återgå till sin aktiva form och bryta ner och frisätta antitrombinet.
Martinez-Martinez hoppas att förståelse för betydelsen av denna region av antitrombin kan leda till bättre läkemedel för att förhindra blodpropp genom att aktivera antitrombin eller förhindra blödning genom att hämma det. Hon betonar också att den väsentliga naturen hos denna domän av proteinet inte kunde ha förutspåtts genom att bara studera sekvenserna av friska antitrombiner.
"Detta arbete har varit möjligt tack vare karakteriseringen av mutationer som identifierats hos patienter, " sa Martinez-Martinez.
Arbetet finansierades av stiftelserna Instituto de Salud Carlos III och FEDER samt Fundación Séneca.