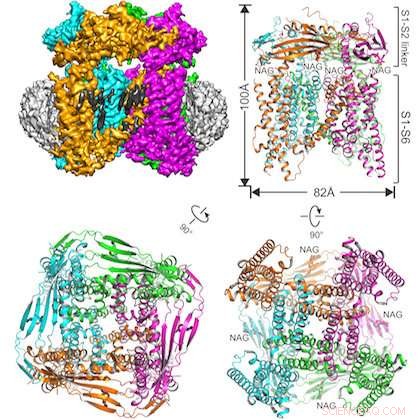
Illustrationen visar det studerade proteinet inbäddat i en nanodisk struktur (överst till vänster) och tre vyer av TRPML1-jonkanalen från olika vinklar. Kredit:UT Southwestern
Forskare från UT Southwestern Medical Center publicerade idag en 3D-atomstruktur av jonkanalen som finns hos däggdjur som är inblandad i en sällsynt, ärftlig neurodegenerativ sjukdom hos människor. Arbetet markerar den första sådan struktur som fastställts med hjälp av universitetets 17 miljoner dollar kryoelektronmikroskopi (cryo-EM) anläggning som öppnade förra året.
I cryo-EM, prover fryses snabbt för att förhindra bildandet av skadliga iskristaller och ses sedan vid minus 321 grader Fahrenheit (kryogena temperaturer). UT Southwesterns anläggning – som är igång dygnet runt – är en av världens främsta anläggningar för kryo-EM-strukturbiologi.
Det tvärvetenskapliga teamet löste strukturen för musens TRPML1 (transient receptor potential mucolipin 1) jonkanal.
Deras studie, publicerad online av Natur , kommer bara en vecka efter att tre utvecklare av kryo-EM-teknik belönades med 2017 års Nobelpris i kemi för deras arbete med de instrument och metoder som utlöste "upplösningsrevolutionen". Cryo-EM möjliggör vyer på atomnivå av proteiner som motstår den kristallisering som krävs för traditionell röntgenkristallografi.
"Fungerande jonkanaler behövs för korrekt rörelse av elektriskt laddade partiklar - joner - in och ut ur celler och organeller för att driva cellulära processer, " sa Dr Youxing Jiang, Professor i fysiologi och biofysik, en utredare vid Howard Hughes Medical Institute (HHMI), och medförfattare till studien.
TRPML1-kanalen, som reglerar flödet av kalciumjoner, finns i varje däggdjur. Kanalen sitter i membranet av organeller inuti celler som kallas lysosomer, som innehåller enzymer som hjälper till med cellulär återvinning genom att bryta ner stora molekyler.
Cirka 50 lysosomala lagringssjukdomar (LSD) har identifierats hos människor, inklusive en klass av LSD orsakad av funktionsförlustmutationer i gener som styr TRPML1-kanalerna. Denna LSD, kallas mukolipidos typ IV, kännetecknas av försenad utveckling av mentala och motoriska färdigheter och synnedsättning, enligt National Institutes of Health.
"På grund av dess koppling till den klassen av lysosomala lagringssjukdomar, TRPML1 har varit ett potentiellt mål för småmolekylära terapier och flera potentiella agonister (kanalöppnare) har utvecklats, " sa Dr Jiang, en W.W. Caruth, Jr. forskare i biomedicinsk forskning. Bestämning av TRPML1:s struktur kan hjälpa till i sökandet efter behandlingar för mukolipidos typ IV, han sa.
UT Southwesterns cryo-EM-anläggning rymmer tre högteknologiska instrument, inklusive en 12½ fot lång, 2-tons Titan Krios som skjuter en kraftfull stråle genom varje prov medan en speciell kamera tar bilder av de spridda elektroner som blir resultatet. En robotarm inuti maskinen kan hålla och exakt flytta ett dussin blixtfrysta prover på ett automatiserat sätt så att tusentals bilder kan spelas in, bearbetas via datorer, och tolkas för att generera 3D-bilder för studier, förklarade forskarna.

UTSW-forskargruppen som bestämde 3D-atomstrukturen för en jonkanal inkluderar (nedre raden, från vänster) Drs. Youxing Jiang och Xiaochen Bai, och (översta raden, från vänster) Jiangtao Guo, Quingfeng Chen, Weizhong Zeng, och Ji She. Kredit:UT Southwestern
En annan skillnad i denna studie är den framgångsrika användningen av en relativt ny provberedningsteknik:inbäddning av proteinet av intresse i en nanodisk struktur gjord av lipider och andra biologiska material. Huvudförfattare Dr. Qingfeng Chen, en postdoktor vid Jiang-laboratoriet, skapade provet.
"Under en lång tid, tvättmedel har använts för att extrahera proteiner från membran för studier. Människor har föreslagit att tvättmedel kan ändra proteinstrukturen från dess ursprungliga tillstånd, " sa Dr Xiaochen Bai, en biträdande professor i biofysik och cellbiologi och studiens andra motsvarande författare. "Membranproteiner, som de vi studerade, är vanligtvis insvepta i lipider. Nanoskivor används för att tillhandahålla en naturlig miljö för proteinprovet."
Dr. Bai är specialiserad på den sofistikerade programvaran som används för att avslöja organisationen av individuella atomer inom varje partikel. Han rekryterades till UT Southwestern som Cancer Prevention and Research Institute of Texas (CPRIT) Scholar och Virginia Murchison Linthicum Scholar i medicinsk forskning efter fem års utbildning vid MRC Laboratory of Molecular Biology i Cambridge, STORBRITANNIEN.
Arbeta i ett team som utvecklar vad som har blivit ett av de bästa mjukvaruprogrammen för att bearbeta bilddata som genereras av elektronmikroskopin, Dr Bai hade många samtal med Dr Richard Henderson, en av tre forskare tilldelade Nobelpriset i kemi förra veckan.
"Han tillbringade dag och natt i labbet och arbetade med metodutveckling för cryo-EM. Ett av hans stora bidrag var utvecklingen av en ny typ av kamera för att ta bättre bilder av proteinerna som studerats med cryo-EM, " sa Dr. Bai. "När jag först flyttade till England, han gav mig mycket vägledning och stöd och vi hade många diskussioner om kryo-EM-tekniker."