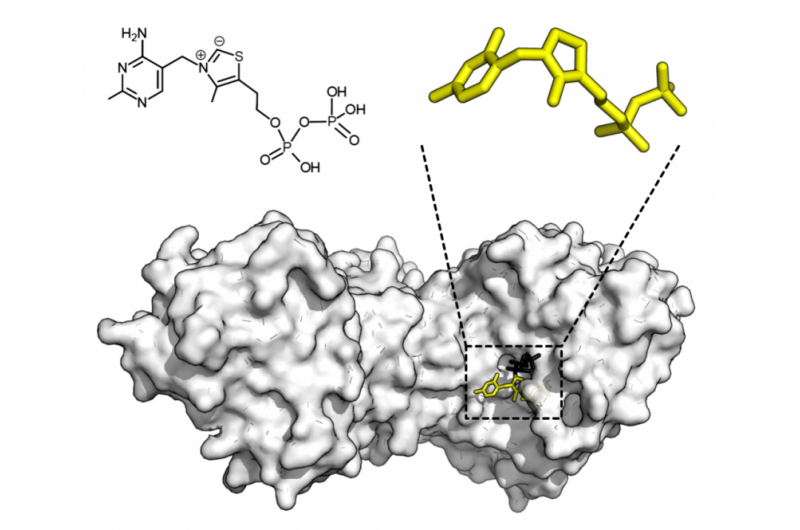
Kemisk struktur för tiaminpyrofosfat och proteinstruktur av transketolas. Tiaminpyrofosfatkofaktor i gult och xylulosa 5-fosfatsubstrat i svart. Upphovsman:Thomas Shafee/Wikipedia
Forskare från institutionerna för kemi och teknik vid University of Oxford har hittat ett allmänt sätt att förutsäga enzymaktivitet. Enzymer är proteinkatalysatorerna som utför de flesta av nyckelfunktionerna inom biologi. Publicerad i Natur kemisk biologi , forskarnas nya AI -tillvägagångssätt är baserat på enzymets sekvens, tillsammans med screening av en definierad "träningsuppsättning" av substrat och rätt kemiska parametrar för att definiera dem.
Enzymer är målet för många läkemedel. Om forskare kan förutsäga sina funktioner, de kan sedan hämma dessa funktioner med små molekyler - i vissa fall för att behandla sjukdomar. Denna forskning kommer att vara avgörande för att skapa en helhetsbild som ger en fylligare och mer fullständig förståelse av biologi och hälsa.
Forskarna tog itu med en hel familj av enzymer från en växtart. De kombinerade uttryck med hög genomströmning av enzymerna från motsvarande gener, därefter screenade deras enzymatiska aktivitet genom kvantitativ, etikettfri masspektroskopi. Enkel analys av enzymets primära sekvens ger inget riktigt mönster för aktivitetsförutsägelse, men i kombination med AI -tekniker från Oxford University's Machine Learning Group, standard kemiska deskriptorer kan härleda ett kraftfullt prediktivt system.
Ben Davis, Professor i kemi vid University of Oxford säger, "Det viktigaste är att denna metod snarare än att vara" svart låda "ger tillbaka till kemisten/biologen framgångsrika förutsägelser och orsaker till de förutsägelser som har kemisk och biologisk betydelse. Detta har i sin tur gjort det möjligt för oss att räkna ut vilka enzymer som kan användas i syntes, förutsäga aktiviteten hos enzymer från mycket olika arter (till och med bakterier) och att räkna ut hur man konstruerar enzymer på ett nytt sätt baserat på förslag som vi inte skulle ha förutsagt. "
Han tillägger:"Vi ser detta som en mycket kraftfull upptäcktsmotor. Det kommer att slänga spännande möjligheter i mixen för hypotesprovning. Med tanke på det senaste kemiska Nobelpriset i provrörsutveckling av enzymer, AI som tillämpas på enzymer för ökad förståelse kan visa sig vara en mycket kraftfull nästa gräns. "
Stephen Roberts, professor i maskininlärning i informationsteknik vid University of Oxford säger:"Vi lever i en tid med stora data och stora modeller, men inte nödvändigtvis med stor kunskap eller insikt. Verkligen, karaktären hos många komplexa, välpresterande modeller döljer detaljerna om framgång, vilket leder till "black-box" -lösningar som saknar klar tolkbarhet. I skarp kontrast, den vetenskapliga metoden bygger in insynsutdrag i sin kärna. I denna forskning har vi visat att modeller som ger transparens och insikt fortfarande kan driva vetenskapliga framsteg. "
Detta stora framsteg möjliggör framgångsrika proteinkatalysatoraktivitetsprognoser, vilket har konsekvenser för ett stort antal områden, inklusive medicinsk forskning. Det är ett betydligt mer utmanande område än modellering av småmolekylära katalysatorer som har varit höjdpunkten inom maskininlärning/kemi fram till nu.