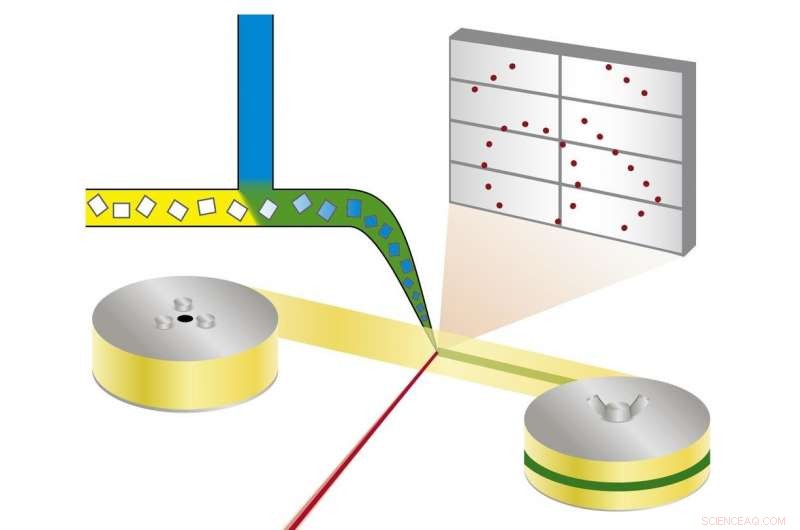
Principen för mix-and-diffus seriell synkrotronkristallografi:proteinkristaller blandas med en lösning av en läkemedelskandidat och röntgas på ett band som löper genom röntgenstrålen. Kredit:Beyerlein et al., IUCrJ
Forskare vid DESY har utvecklat en ny metod som möjliggör automatiserad och snabb screening av lovande läkemedelskandidater. Denna nya teknik, kallad mix-and-diffus seriell synkrotronkristallografi, kan avbilda interaktionen mellan potentiella läkemedelsmål med läkemedelskandidater eller andra molekyler. Konceptet har potential att ta struktur och fragmentbaserad läkemedelsdesign till en ny nivå, som forskarna skriver i Journal of the International Union of Crystallography ( IUCrJ ).
Många proteiner i kroppen är potentiella läkemedelsmål. Farmaceutiska molekyler med rätt form kan binda till dessa proteiner och aktivera eller inaktivera deras funktion. Till exempel, för att bekämpa vissa former av leukemi, cancerläkemedlet Imatinib hämmar en överaktiv variant av enzymet tyrosinkinas, ett protein som ansvarar för att aktivera många andra proteiner. Imatinib blockerar det aktiva stället för detta tyrosinkinas. För att åstadkomma detta, läkemedelsmolekylen måste passa in exakt i den aktiva platsen som en nyckel i ett lås. Baserat på kunskapen om den rumsliga strukturen av enzymmålet, Imatinib skräddarsyddes för detta ändamål.
"Denna strategi kallas strukturbaserad läkemedelsdesign och används numera som en standardmetod inom läkemedelsutveckling, " förklarar första författare Kenneth Beyerlein från Center for Free-Electron Laser Science (CFEL), ett samarbete mellan DESY, universitetet i Hamburg och tyska Max Planck Society. "Dock, i verkligheten är det mycket mer komplext att rikta in sig på proteiner än att montera en nyckel i ett lås. Därför, många potentiella farmaceutiska molekyler eller fragment av sådana molekyler måste testas, vilket vanligtvis är en lång och komplicerad procedur." både biologer och farmakologer är intresserade av den exakta funktionen hos naturliga ämnen som binder till proteiner, för att bättre förstå livets maskineri.
Systemet utvecklat av teamet kring Beyerlein och hans DESY-kollega Dominik Oberthür, även från CFEL, erbjuder ett nytt sätt att sträva efter detta mål:Den blandar mikrokristallina proteiner med specifika molekyler som kallas ligander som kan vara läkemedelskandidater eller naturliga medel precis innan man undersöker kristallerna med röntgenstrålar för att avslöja den detaljerade rumsliga strukturen av det resulterande protein-ligandkomplexet eller frånvaro av ett sådant komplex om en potentiell ligand inte binder till proteinet.
För att analysera den rumsliga strukturen av ett protein, forskare använder ofta röntgenkristallografi. För denna teknik, en kristall måste odlas från proteinet först. Forskare tar sedan röntgenbilder från alla sidor av kristallen som måste kylas till ultralåga temperaturer för att minska skadorna från den intensiva strålningen. Röntgenstrålarna producerar ett karakteristiskt diffraktionsmönster från vilket den inre strukturen av kristallen och därmed proteinets rumsliga struktur kan beräknas. För att undersöka ett protein med en ligand, en ny kristall måste odlas från en protein- och ligandlösning eller så måste kristallen blötläggas med liganden. Även med användningen av robotik för att automatisera alla steg i denna process, behovet av att montera individuella kristaller för varje ny datauppsättning har blivit det hastighetsbegränsande steget vid screening av stora sammansatta bibliotek.
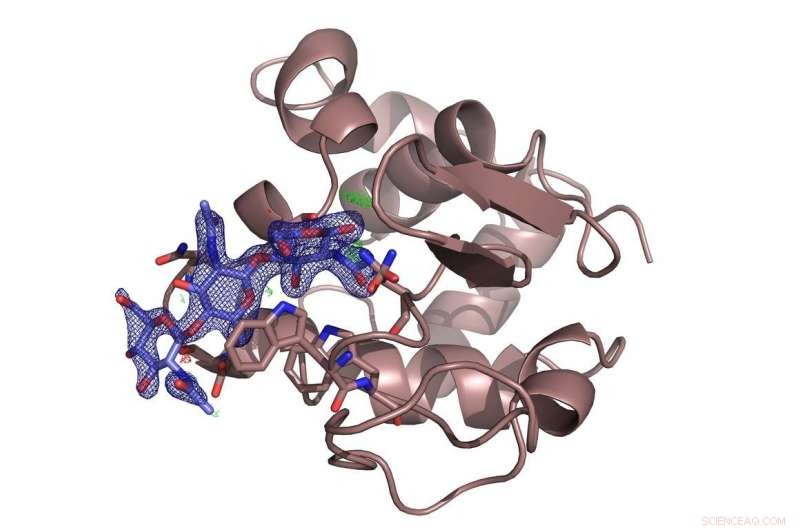
Enzymet lysozym (brunt) med det hämmande sockret kitotrios (blått) bundet till det. Undersökningen avgjorde en kontrovers över det föredragna bindningsstället för sockermolekylen. Kredit:DESY, Dominik Oberthür
Den nya tekniken följer ett annat tillvägagångssätt. "Vi använder mikrokristaller som har två fördelar:De är vanligtvis mycket lättare att producera än stora kristaller, och de är tillräckligt små så att ett potentiellt läkemedel i en lösning kan diffundera genom kristallen och binda till alla proteinmolekyler inom några millisekunder, " förklarar Oberthür. Systemet som utvecklats av teamet Oberthür och Beyerlein dispenserar en ström av mikrokristaller i en bärarvätska på en tunn tejp. Som ett transportband, bandet bär kristallerna genom röntgenstrålen, som hackas till korta blixtar av en roterande persienn. Istället för att rotera en stor kristall i röntgenstrålen, många mikrokristaller i slumpmässig orientering utsätts således för röntgenstrålar på ett seriellt sätt och diffraktionsmönstren från varje skott kombineras senare för att bilda en komplett datauppsättning, efter konceptet seriell kristallografi som först utvecklades vid frielektronröntgenlasrar (XFEL).
Genom en andra ventil i systemet, en lösning av en läkemedelskandidat eller naturlig ligand tillsätts. Punkten där de två vätskorna blandas kan justeras för att skapa en definierad fördröjning innan strukturen undersöks. Denna uppställning kräver inte kryokylning av kristaller, därför kan protein-läkemedelsinteraktionen observeras vid fysiologiska temperaturer, eller någon annan önskad temperatur. Den här vägen, även bindningsdynamiken kan undersökas. "Vi kan sprida kemikalier in i proteinkristallerna i farten och se bindningen ske, " förklarar Oberthür. "Du behöver inte hitta nya tillväxtförhållanden för varje hämmare och du behöver inte byta ut kristallerna manuellt, hela processen kan automatiseras."
Teamet testade det nya systemet på DESYs högbriljans röntgenkälla PETRA III med det välkända proteinet lysozym och en sockermolekyl, chitotriose, som hämmar enzymet. Lysozymmikrokristallerna som användes här var bara cirka sex till åtta mikrometer i diameter. Uppställningen vid mätstation P11 avslöjade den rumsliga strukturen av den inblandade inhibitorn bunden till lysozym i detalj. Och även om strukturen av lysozym var den första enzymstrukturen som avslöjades av röntgenkristallografi för 50 år sedan, den nya metoden kan fortfarande avslöja nya detaljer om bindningssättet för kitotrios till lysozym, lösa en kontrovers om det föredragna bindningsstället för sockermolekylen.
Även om principbeviset fortfarande krävde lite tid, rutin och ytterligare framsteg inom detektor- och röntgenteknik kommer att påskynda proceduren avsevärt. Också, använda hela röntgenstrålespektrumet från synkrotronljuskällan istället för bara en enda "färg" från den, kan sänka exponeringstiden för individuella diffraktionsbilder till 100 pikosekunder, eller 0,1 miljarddels sekund. Bara 50 av dessa bilder räcker för att bestämma strukturen, som nyligen visades.
"Vi utvecklar sätt att lösa strukturen av bundna proteiner för upptäckt av läkemedel med hög genomströmning, " förklarade Beyerlein. Eftersom synkrotronljuskällor är mer tillgängliga än röntgenlasrar, forskarna föreställer sig att använda denna metod för rutinmässig screening genom bibliotek av potentiella hämmare och läkemedelsfragment. "Att göra detta automatiskt och mycket snabbare än med konventionella metoder skulle vara ett stort steg framåt i strukturbaserad läkemedelsdesign, säger Beyerlein.