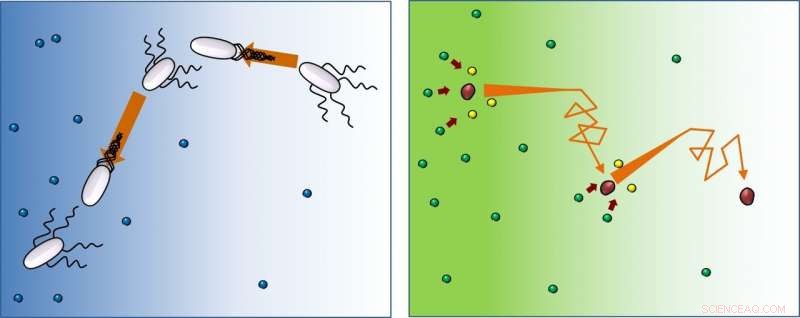
I närvaro av mat (blå), bakterier (vita) simmar rakt, ändra sedan orientering (tumla), och följ detta mönster om och om igen. Denna studie visar att enzymer (röda) rör sig på samma sätt, men efter att ha reagerat med substrat (från grönt till gult), de fortsätter att rinna-och-tumla bort från den högre koncentrationen av substrat. Kredit:IBS
Även om orden "slumpmässigt" och "partisk" kan verka som en sammandrabbning, det här är attributen som beskriver hur bakterier navigerar och hämtar sin mat. De följer en slumpmässig väg, men partisk mot riktningen av näringsämnenas källa. Forskare vid Centrum för mjuk och levande materia, inom Institutet för grundvetenskap (IBS, Sydkorea), observerade att enzymer, molekylerna som hjälper biologiska reaktioner att ske snabbare, rör sig med ett liknande mönster, men på den motsatta vägen - slumpmässigt färdas mot området med färre substrat. Dessa resultat, erhållits med ny optisk teknologi och publicerad som en inledande artikel i Proceedings of the National Academy of Sciences (PNAS) , är särskilt spännande eftersom de utgör ett avsteg från den traditionella uppfattningen.
Tusentals enzymer främjar en mängd reaktioner i våra kroppar, som var och en upprätthåller våra liv. Enzymer verkar på andra kemikalier som kallas substrat och påskyndar kemiska reaktioner som omvandlar substrat till produkter. Att göra det, enzymer och substrat måste mötas. Man trodde ursprungligen att enzymer och deras motsvarande substrat slentrianmässigt stöter på varandra:"Standardläroböcker nämner att enzymer och substrat är tänkta att komma nära" på något sätt, " interagera, och det är så reaktioner råkar ske. Vi försökte gräva ner oss i "på något sätt" delen av denna process. Efter att ha samlat tusentals händelser drog vi slutsatsen att enzymernas gång är slumpmässigt partisk, vilket betyder att de är mikroskopiskt riktade, som bakterier, " förklarar Ah-Young Jee, första författare till denna studie.
Simbakteriers rörelse kallas "spring-och-tumla":spring, vänd och upprepa. De går i en riktning, ändra sedan riktning slumpmässigt, och upprepa. Dock, medan bakterier orienterar sig mot matförsörjningen, enzymer rör sig i riktning mot lägre substratkoncentration. "Molekyler saknar förmåga att fatta beslut, men rör sig överraskande nog mot områden med mindre substrat. Verkligen, substratet introducerar riktningsförspänningen, och ju högre substratkoncentration vi använde i experimentet, desto starkare är denna tendens. Vi antar att det kan vara ett sätt att göra produktkoncentrationen enhetlig runt mediet, även när substratkoncentrationen inte är det, säger prof. Tsvi Tlusty, som erbjöd den teoretiska förståelsen av denna forskning.
Eftersom varje enzyms steg bara är cirka 50 nanometer långt, extremt exakta enheter behövs för att mäta deras hastighet och orientering. Forskargruppen, ledd av Steve Granick, tittade på den enzymatiska rörelsen med en superupplösningsmikroskopiteknik, känd som stimulerad emission-utarmning fluorescenskorrelationsspektroskopi, eller STED-FCS för kort.

A) Enzym-substrat-buffert (E+S+B) kommer in i det vänstra inloppet, och enzymbuffert (E+B) injiceras till höger inlopp. På det här sättet, enzymkoncentrationen är enhetlig över hela chipet, medan substratkoncentrationen är högre på vänster sida (blå) och gradvis minskar mot höger (vit). Rektangeln med streck indikerar området där enzymrörelsen studeras i detalj med hjälp av STED-FCS mikroskopiteknik. B) Koncentrationen av enzymet ureas (svart) och koncentrationen av urea (dess substrat, grå) plottas mot positionen inom FCS-zonen, mellan 0 och 2,5 millimeter från laserstrålen. Skalan vid varje punkt är en felstapel, visar standardavvikelsen över fem upprepade mätningar. C) Diffusionskoefficienten (Da), som indikerar hur snabbt enzymet rör sig, förändras inte i frånvaro av substrat, men det ökar när substratet är närvarande, vilket betyder att enzymet rör sig snabbare åt höger. Kredit:IBS, publicerar i PNAS
I FCS-metoden, enzymer är dekorerade med fluorescerande molekyler och deras passage genom en liten prick detekteras av en laserstråle. Statistisk information samlas in, såsom antalet enzymer som passerar genom pricken och deras hastighet (diffusionshastighet). Teamet kompletterade FCS med STED-teknik, en av styrkorna med detta forskningscenter. STED koncentrerar laserstrålen till ett extremt litet område, möjliggör en mer förfinad mätning av enzymernas position. FCS-laserstrålen täcker en yta på cirka 250 nanometer i diameter, vilket är ungefär 25 gånger enzymets diameter (10 nanometer). STED-FCS är mer exakt eftersom den minskar strålens diameter till 50 nanometer, vilket är jämförbart med avståndet för ett enzyms steg.
Forskarna designade också ett nytt mikrofluidikchip, bildas av mikrometertjocka kanaler där vätskor kan passera. Tidigare studier, använder FCS utan STED och ett annat mikrofluidikchip, föreslog att enzymerna rör sig mot området med den högsta koncentrationen av substrat. Dock, denna nya teknik möjliggör djupare observationer och visade motsatsen. Författarna tror att resultaten skiljer sig åt eftersom detaljerad information om enzymrörelsen avbröts med en större laserstråle. Det skulle likna att lokalisera någon inom 50 kvadratkilometer eller inom 2 kvadratkilometer, det senare är mer exakt. De skapade förhållanden där enzymet är jämnt fördelat inuti chipet, men substratkoncentrationen varierar från vänster till höger:från en minimikoncentration på höger sida av chipet, till en maximal koncentration till vänster. Sedan, de använde FCS för att observera enzymets koncentration och hastighet inuti chipet, och fann att enzymet tenderar att accelerera mot området med lägre substratkoncentration (det vill säga mot höger sida av chipet). Istället, när inget substrat är närvarande, enzymerna ändrar inte sin hastighet. Dessutom, superupplösningsförmågan hos STED-FCS visade kör-och-tumla dynamik.
Teamet observerade samma beteende med två enzym-substratpar separat:ureas-urea och acetylkolinesteras (AChE)-acetylkolin. Det förra enzymet används av vissa mikroorganismer för att omvandla urea till ammoniak och kolsyra, den senare spelar en väsentlig roll i neuromuskulära förbindelser.
I framtiden, forskargruppen syftar till att utöka komplexiteten i studien och testa förhållanden som mer liknar det verkliga livet:"Denna studie tittade på beteendet hos ett enzym som svar på ett substrat. Nästa, vi planerar att titta på flera enzymer samtidigt. Vår kropp fungerar med en kaskad av reaktioner, vilket betyder att en reaktion utlöser nästa:enzym A utlöser enzym B, då triggar B C, och så vidare. STED-FCS-analys kan vara ett nyckelverktyg för att främja metabol forskning genom att avslöja hur dessa multipla enzymsystem är organiskt relaterade, avslutar Jee.