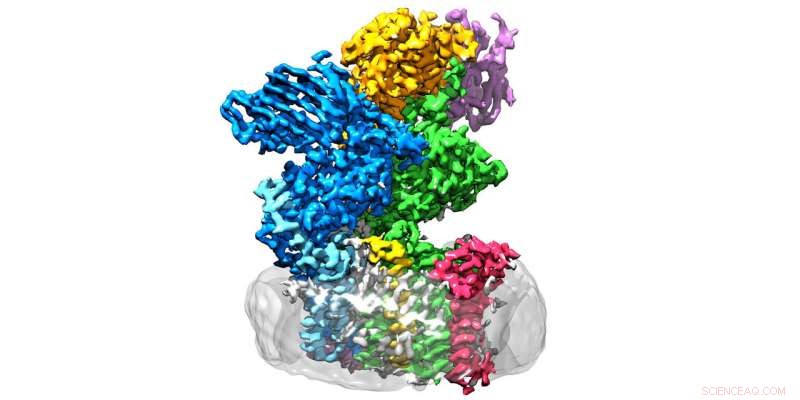
Enzymet oligosackaryltransferas finns i membranet (grå) och består av åtta subenheter. Kredit:Julia Kowal / ETH Zürich
ETH-forskare har lyckats fastställa 3D-strukturen hos enzymet som fäster sockerkedjor till proteiner – ett genombrott som de nyligen publicerade i tidskriften Vetenskap .
Närhelst celler tar emot signaler, interagerar med andra celler eller identifierar virus och bakterier, processen involverar inte bara proteiner utan även sockerkedjor som är fästa på deras yta. Ämnet som har fått relativt lite uppmärksamhet hittills, dessa strukturer skiljer sig mycket åt i sammansättning och förgrening, och verkar hjälpa till att säkerställa att proteiner viker sig korrekt och kan utföra sina specifika uppgifter.
Flera observationer visar vikten av de sockerhaltiga bihangen:identiska proteiner med olika sockerkedjor har olika funktioner, sjuka och friska celler har olika sockersammansättningar på sina ytor, och droger som de är knutna till tolereras tydligen bättre.
Hur kommer sockret vidare till proteinet?
Känd som glykaner, Dessa ämnen är för närvarande föremål för intensiv forskning. Efter genomik och proteomik, det finns nu också glykomik. Det framväxande forskningsfältet glykobiologi handlar om biosyntes, struktur och de olika funktionerna hos de sockerhaltiga bihangen. En nyckelfråga är hur den olika uppsättningen av sockermolekyler når proteinerna i första hand.

Kryoelektronmikroskopbilder av enzymet. Kredit:Rebekka Wild / ETH Zürich
ETH-forskare i grupperna som leds av Kaspar Locher från Institutet för molekylärbiologi och biofysik och Markus Aebi från Institutet för mikrobiologi har nu tagit ett avgörande steg framåt på detta område:de har bestämt den tredimensionella strukturen av oligosackaryltransferas (OST) i jäst. "Detta är enzymet som kopplar proteiner till sockerträd, " förklarar Rebekka Wild, en av de tre huvudförfattarna till rapporten i Vetenskap där ETH-forskarna presenterar sina resultat.
Att bestämma strukturen för OST var inte lätt:till att börja med, Jilliane Eyring, rapportens tredje huvudförfattare, modifierade jästcellerna så att enzymet kunde målinriktas och renas. Wild var först tvungen att extrahera enzymet, som är inbäddad i ett membran i cellen, från stora mängder av dessa jästceller och sedan rena den i ett mödosamt förfarande. "Nio liter jäst producerade cirka 0,2 milligram enzym, " säger hon. OST-molekylerna applicerades på ett litet rutnät, blixtfryst som individ, separera partiklar och avbildas med ett högupplöst kryoelektronmikroskop.
Detta gav upphov till tusentals bilder som visar enzymkomplexet från alla möjliga betraktningsvinklar. Från dessa bilder, Julia Kowal, den andra huvudförfattaren, genererade den tredimensionella strukturen för OST. Det tog sex veckor att utföra beräkningarna på datorklustret. Resultatet blev en elektrondensitetskarta som visar enzymet som ett "elektronmoln".
"Vi tog ett lyckligt ögonblick, " förklarar Wild. De kunde dra nytta av den "upplösningsrevolution" som för närvarande äger rum inom kryoelektronmikroskopi och använda sig av en toppmodern anordning med atomupplösning. Utvecklingen av denna teknik belönades med Nobelpriset i kemi 2017.
För att tolka elektronmikroskopidata, Wild var tvungen att passa in aminosyrasekvensen för OST "manuellt" i de små molnen i den tredimensionella kartan. Således, forskaren kunde skildra 3D-strukturen av OST i full detalj – ett genombrott som möttes med glädje bland forskare efter att det publicerats online.
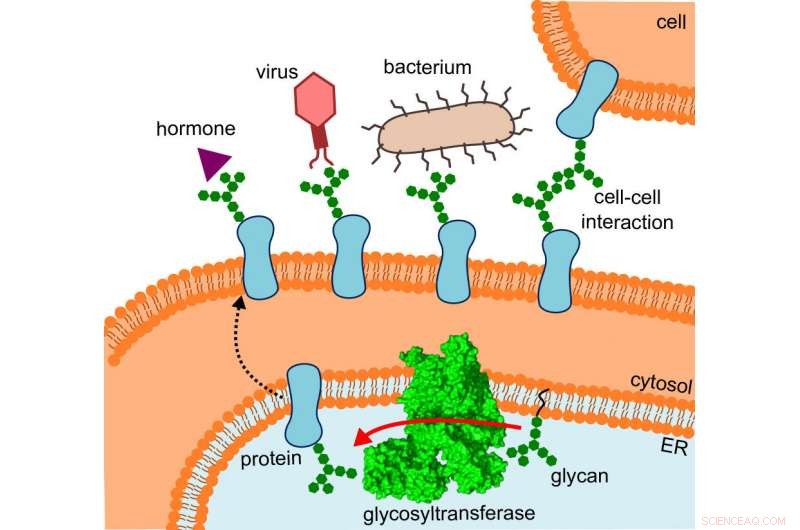
Diagrammet visar var glykosyltransferaset finns, vägen de förändrade proteinerna tar och de interaktioner de genomgår. Kredit:R. Wild / ETH Zürich
OST är ett membranproteinkomplex som består av åtta underenheter, som identifierar, till exempel, socker- eller proteinsubstraten eller stabilisera den katalytiska enheten. Den senare är underenheten av enzymet som hyser det aktiva centret, där proteiner och sockerarter förs samman och smälts samman. "Vi hade förväntat oss att den katalytiska enheten skulle vara i mitten av enzymet, Wild förklarar. dock, det är på utsidan – och formen påminner om en vidöppen mun."
Det som från början förvirrade forskarna var plötsligt vettigt, när de monterade strukturen på den plats där OST faktiskt är verksam:specifikt, enzymet är inbäddat in vivo i membranet av det endoplasmatiska retikulumet (ER). Detta är den del av cellen där proteiner produceras, vikta, övervakas och modifieras.
Här, OST:s direkta granne är ett tunnelprotein – så mycket var redan känt. Detta leder de nystartade proteinerna in i det inre av det endoplasmatiska retikulumet och sedan direkt in i den vidöppna munnen på OST, där de tar emot sina små sockerträd.
"Jäst OST är en bra modell för processerna hos människor, Wild förklarar. Forskarna drar denna slutsats från det faktum att jäst OST:s aktiva centrum, där proteinerna är försedda med socker, påminner mycket om motsvarande område hos bakterier. "Detta betyder att det aktiva centret knappt har förändrats under evolutionens gång, " förklarar forskaren, "vilket betyder att det finns en god chans att det fortfarande fungerar på ett mycket liknande sätt hos däggdjur, och därför även hos människor."