Om den ändrar sin polaritet, detta orsakar ett eko i den magnetiska markören, från vilket avståndet kan beräknas. Kredit:© AG Schiemann/Uni Bonn
Forskare vid universitetet i Bonn har utvecklat en metod med vilken ett enzym som fungerar kan "fotograferas". Deras metod gör det möjligt att bättre förstå funktionen hos viktiga biomolekyler. Forskarna hoppas också få insikter om orsakerna till vissa enzymrubbningar. Studien kommer att publiceras i tidskriften Kemi – En europeisk tidskrift .
Om en utomjording såg en bild av en sax för första gången i en hantverkskatalog, han skulle nog inte ha någon aning om vad vi jordbor använder den här saken till. Om, å andra sidan, han skulle visas en video där saxen öppnas och stängs, han kunde kanske härleda deras funktion med lite fantasi.
Forskare har ett mycket liknande tillvägagångssätt när de vill förstå hur ett enzym fungerar:om de överhuvudtaget känner till molekylens struktur, då oftast bara som stillbild. De vet inte hur enzymet beter sig i aktion, vilka delar som rör sig mot varandra och vilka delar som rör sig bort från varandra.
Enzymer katalyserar vissa kemiska reaktioner i cellerna, jämförbar med saxar som klipper papper. De har katalytiska centra (bladen) som kommer i kontakt med utgångsmaterialet (papperet). "Enzymets tredimensionella form förändras vanligtvis under denna process, " förklarar prof. dr. Olav Schiemann från Institutet för fysisk och teoretisk kemi vid universitetet i Bonn. "Normalt, dessa konformationsförändringar kan inte göras synliga, eller bara med stor ansträngning. Detta gör det ofta svårt att förstå katalysmekanismen."
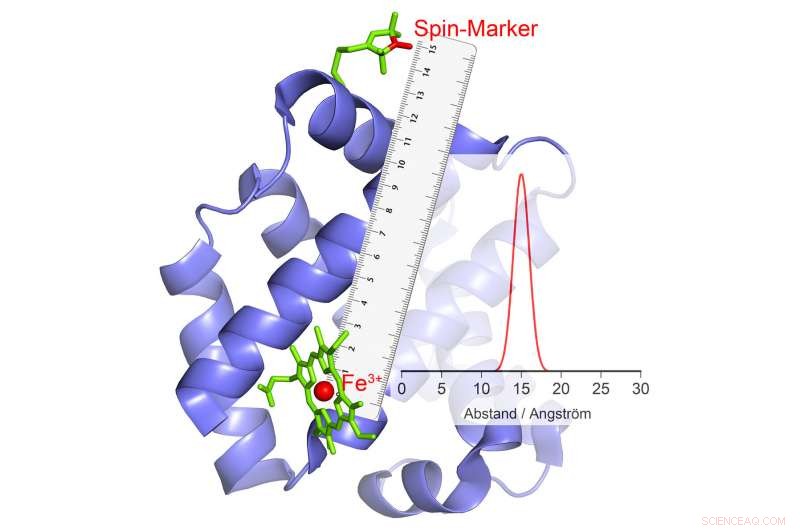
Schiemanns forskargrupp har lyckats utveckla en metod med vilken delar av proteinets rörelser mot varandra kan mätas under katalysförloppet. Bonnforskarna har arbetat med sådana metoder med stor framgång i flera år nu. I deras nuvarande studie, de har undersökt en särskilt viktig grupp enzymer. Dessa bär metalljoner med många oparade elektroner i sina katalytiska centra. Ett exempel är hemoglobin, som binder syre med hjälp av en järnjon och kan därmed transporteras i blodet.
Vändande joner
"Våra nuvarande metoder är olämpliga för sådana högspin-joner, " förklarar Schiemanns kollega Dr. Dinar Abdullin. "Vi utvecklade därför en ny metod, utarbetade teorin och testade den framgångsrikt." Forskarna använde sig av det faktum att högspin-joner beter sig som små elektromagneter. Dessutom, de kan slumpmässigt ändra sin polaritet – de "vänder":Nordpolen blir Sydpolen och Sydpolen blir Nordpolen.
Detta fenomen kan användas för avståndsmätning. Här, forskarna kopplar enzymet till vissa kemiska föreningar som också har elektromagnetiska egenskaper. "När jonerna med hög spin vänder, dessa små elektromagneter reagerar på det förändrade magnetfältet i sin omgivning genom att också ändra sin polaritet, " förklarar Abdullin. När och hur de gör detta beror på, bland annat, på avståndet till högspinjonen. Detta gör det möjligt att bestämma avståndet mellan de två så noggrant.
Om flera magnetiska grupper är bundna till ett enzym, avståndet för var och en av dessa grupper till högspinjonen och därmed till det katalytiska centrumet erhålls. "Genom att kombinera dessa värden, vi kan mäta den rumsliga positionen för detta centrum, som om vi använde en molekylär GPS, " förklarar Schiemann. "T.ex. vi kan bestämma hur dess position förändras i förhållande till de andra magnetiska grupperna under katalysförloppet."
Dock, forskarna kan ännu inte riktigt se hur enzymet fungerar. "Vi arbetar fortfarande med frusna celler, ", säger Schiemann. "Dessa innehåller många enzymer som frystes vid olika tidpunkter under den katalytiska reaktionen. Så vi får ingen film, men en serie "stillbilder - som om saxen från det inledande exemplet fotograferades vid otaliga olika ögonblick under redigeringsprocessen.
"Men vi jobbar redan på nästa förbättring, " betonar kemisten:"Spatial mätning av biomolekyler i celler och vid rumstemperatur." Forskarna hoppas kunna få insikter i utvecklingen av vissa sjukdomar som utlöses av funktionella störningar av enzymer.