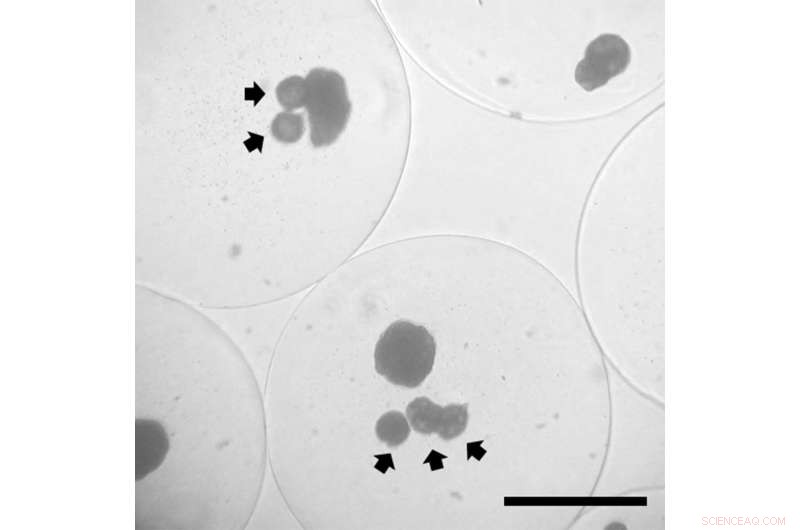
Bukspottkörtelöceller inkapslade tillsammans med mikrosfärer som frisätter ett läkemedel som ökar livsdugligheten i miljöer med låg syrehalt. Mikrosfärerna har pilar som pekar på dem; de större klumparna är cellerna. Kredit:Kevin Kim
En läkemedelsbärande mikrosfär i en cellbärande mikrokapsel kan vara nyckeln till att transplantera insulinutsöndrande bukspottkörtelceller från gris till mänskliga patienter vars egna celler har förstörts av typ I-diabetes.
I en ny in vitro-studie av ingenjörer vid University of Illinois, de insulinutsöndrande cellerna, kallas holmar, visade ökad livskraft och funktion efter att ha tillbringat 21 dagar i små kapslar innehållande ännu mindre kapslar med ett läkemedel som gör cellerna mer motståndskraftiga mot syrebrist. Resultaten publicerades i tidskriften Läkemedelsleverans och translationell forskning .
Forskare har undersökt sätt att transplantera bukspottkörtelöar för att behandla typ I-diabetes på lång sikt, eliminerar behovet av kontinuerlig glukosövervakning och insulininjektioner. Dock, det finns ett antal utmaningar med detta tillvägagångssätt.
"Först, du behöver livskraftiga öar som också är funktionella, så att de utsöndrar insulin när de utsätts för glukos, " sa Illinois el- och datateknikprofessor Kyekyoon "Kevin" Kim, ledaren för den nya studien. Människans öar är få, han sa, men grisvävnad finns i riklig tillgång, och svininsulin har använts för att behandla diabetes sedan 1920-talet.
När öarna väl är isolerade från vävnad, nästa stora utmaning är att hålla dem vid liv och fungerande efter transplantation.
För att förhindra att de transplanterade cellerna interagerar med mottagarens immunsystem, de är förpackade i små, semipermeabla kapslar. Kapselstorleken och porositeten är viktiga för att tillåta syre och näringsämnen att nå holmarna samtidigt som immuncellerna hålls ute.

Metoden som ingenjörerna i Illinois utvecklade tillåter dem att göra små, enhetliga kapslar och kontrollera storleken, möjliggör en kapsel-i-kapsel-teknik. Kredit:Kevin Kim
"De första veckorna efter transplantationen är mycket avgörande eftersom dessa öar behöver syre och näringsämnen, men har inga blodkärl att ge dem, " sa Hyungsoo Choi, studiens medledare och en senior forskare inom el- och datateknik vid Illinois. "Mest kritiskt, syrebrist är mycket giftigt. Det kallas hypoxi, och det kommer att förstöra holmarna."
Kim och Choi har utvecklat metoder för att tillverka sådana mikrokapslar för olika tekniska tillämpningar och insåg att de kunde använda samma teknik för att göra mikrokapslar för biologiska tillämpningar, såsom läkemedelstillförsel och celltransplantationer. Deras metod tillåter dem att använda material med hög viskositet, för att exakt kontrollera kapslarnas storlek och bildförhållande, och att framställa mikrokapslar med likformig storlek med hög genomströmning.
"För en typisk patient skulle du behöva cirka 2 miljoner kapslar. Tillverkning med någon annan metod vi känner till kan inte möta den efterfrågan lätt. Vi har visat att vi kan producera 2 miljoner kapslar på 20 minuter eller så, " sa Kim.
Med sådan kontroll och hög produktionskapacitet, forskarna kunde göra små mikrosfärer som är laddade med ett läkemedel som förbättrar cellviabiliteten och som fungerar under hypoxiska tillstånd. Mikrosfärerna utformades för att ge en förlängd frisättning av läkemedlet under 21 dagar. Forskare förpackade grisöar och mikrosfärerna i mikrokapslar, och under de kommande tre veckorna jämförde dem med inkapslade öar som inte hade de läkemedelsinnehållande mikrosfärerna.
Efter 21 dagar, cirka 71 procent av öarna förpackade med de läkemedelsfrisättande mikrosfärerna förblev livskraftiga, medan endast cirka 45 procent av öarna inkapslade på egen hand överlevde. Cellerna med mikrosfärerna bibehöll också sin förmåga att producera insulin som svar på glukos på en betydligt högre nivå än de utan mikrosfärerna.
Nästa, forskarna hoppas kunna testa sin mikrosfär-inom-en-mikrokapsel-teknik på små djur innan de tittar på större djur- eller människoförsök.