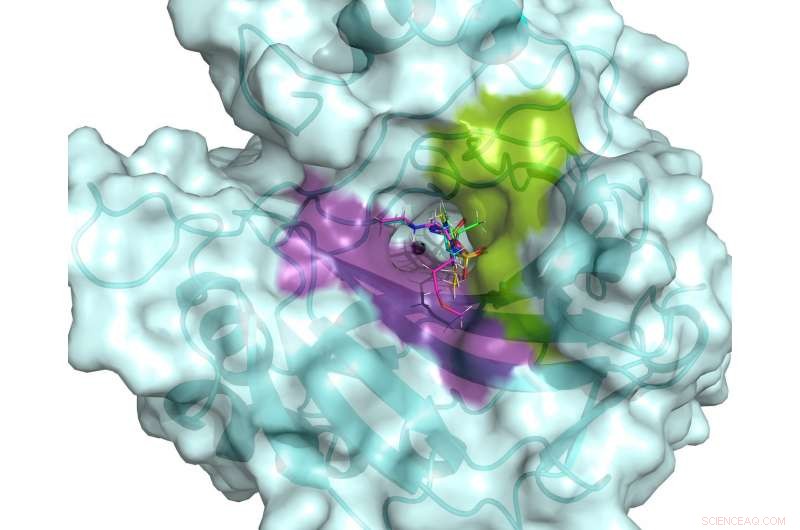
Det aktiva stället för hCA II. Det aktiva stället flankeras av hydrofila (violetta) och hydrofoba (gröna) bindningsfickor som kan användas för att designa specifika läkemedel som riktar sig till cancerassocierade hCAs. Fem kliniska läkemedel visas överlagrade på hCA II aktiva plats, baserad på rumstemperatur neutronstrukturer. Kredit:ORNL/Andrey Kovalevsky
Nya insikter från neutronanalys av glaukomläkemedel och deras enzymmål kan hjälpa forskare att designa läkemedel som mer effektivt riktar sig mot aggressiva cancerformer.
Ett team av forskare som leds av Department of Energy:s Oak Ridge National Laboratory använde makromolekylär kristallografi av neutroner för att undersöka de olika tillstånden hos tre glaukomläkemedel när de interagerar med det riktade enzymet, humant kolsyraanhydras II (hCA II).
"Vårt mål var att observera skillnader i presentationen av tre kliniskt använda glaukomläkemedel medan de är bundna till hCA II-enzymet, "sa Andrey Kovalevsky, en instrumentforskare vid ORNL och en senior medförfattare till studien. "Genom att titta på hur väl dessa läkemedel riktar sig mot hCA II i protonerade, neutrala och deprotonerade stater, vi hoppades få insikter som skulle göra det möjligt att förbättra dessa läkemedel så att de bättre kan rikta in sig på enzymer kopplade till cancer."
Protonation hänvisar till närvaron, tillägg eller förlust av en proton, vilket ger läkemedlet en neutral positiv eller negativ laddning, respektive. Att ändra ett läkemedels laddning kan förändra dess förmåga att känna igen och binda till sitt målprotein och följaktligen dess effektivitet.
Studien, publiceras i tidskriften Strukturera , hittade den temperaturen, pH, och den elektriska laddningen av de tre glaukomläkemedlen påverkade deras förmåga att rikta in sig på och binda med hCA II-enzymet.
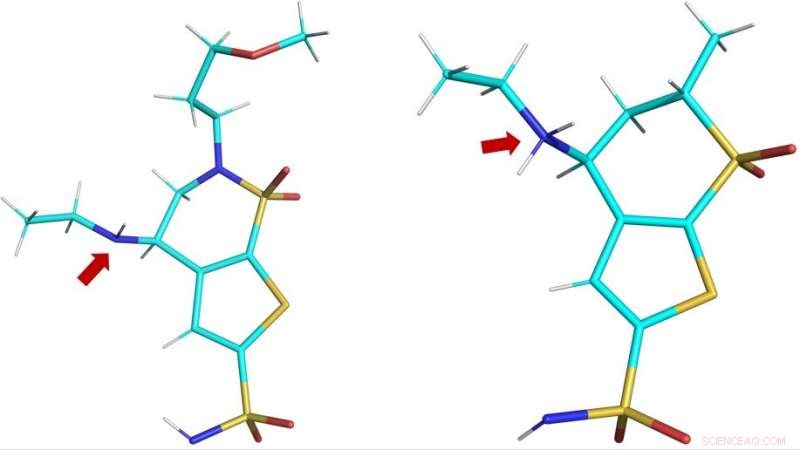
Tredimensionella strukturer för de kliniska läkemedlen brinzolamid (BZM, vänster) anddorzolamid (DZM, höger) som observerats i det aktiva hCA II-stället. Den röda pilen visar läkemedlets aminogrupper:i BZM, kväveatomen (i blått) är inte protonerad och därför inte laddad; i DZM, kväveatomen har tagit emot en extra proton och är således positivt laddad. Kredit:ORNL/Andrey Kovalevsky
"Denna upptäckt var verkligen ett principbevis för oss, "sade Robert McKenna, en professor vid University of Florida och en senior medförfattare till studien. "Det öppnade våra ögon för hur förändringar i temperatur och pH kan påverka läkemedlets protonationstillstånd, vilket i sin tur gör det mer eller mindre effektivt."
Ny information om de vätebindande nätverken som utgör den aktiva platsen för hCA II kan hjälpa andra forskare att utveckla nya och bättre läkemedel för cancerbehandling. Familjen hCA-enzymer innehåller liknande proteiner, såsom hCA IX och XII, som är förknippade med aggressiv bröstcancer, som trippelnegativ bröstcancer.
"Vi vill utnyttja skillnaden i ansvar, pH och temperatur för att se om vi kan designa läkemedel som är mer effektiva för att rikta dessa enzymer, " sa Kovalevsky. "Om vi kan förstå bindning på atomnivå, vi kan göra om läkemedel och förvandla dem till starkare och mer selektiva "magneter" som kommer att lockas av cancerassocierade enzymer. Sådana läkemedel skulle vara mycket effektivare för att döda cancerceller samtidigt som de lämnar friska celler oskadda, vilket avsevärt minskar biverkningar för patienter. "
Många forskare har använt röntgenkristallografi för att analysera strukturerna hos hCA-enymer, men dessa studier saknar fullständig atomär information om läkemedelsbindning på grund av röntgenstrålars oförmåga att visualisera väteatomer som finns i överflöd av proteiner och enzymer.
Neutroner är känsliga för lättare grundämnen, så de ger mycket mer detaljerad information om placeringen av väteatomer. Att se väte är avgörande för att studera protonationstillstånd för ett enzym och en ligand - en molekyl som binder till en biologisk makromolekyl - och för att analysera arkitekturen för vätebindande nätverk. Neutroner erbjuder också andra experimentella fördelar.
"När du använder neutrondiffraktion har du ingen strålningsskada, så att du kan göra dina studier i rumstemperatur, sade McKenna. Dessutom, frysande kristaller kan förändra läkemedlet och enzymet, införa en felaktig syn i studien, medan rumstemperaturstudier mer liknar miljön som läkemedlet kommer att användas i."