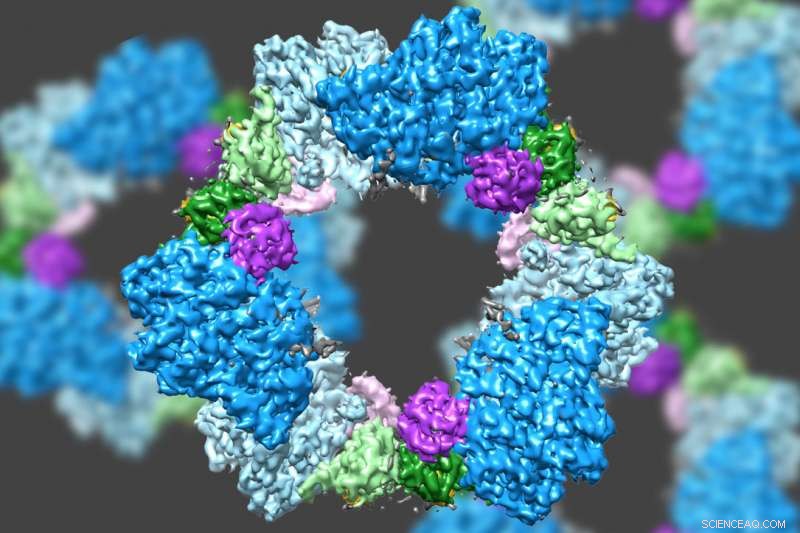
Med hjälp av en toppmodern typ av elektronmikroskopi, ett team som leds av MIT har upptäckt strukturen hos ett enzym som är avgörande för att upprätthålla en tillräcklig tillgång på DNA-byggstenar i mänskliga celler. Kredit:Massachusetts Institute of Technology
Med hjälp av en toppmodern typ av elektronmikroskopi, ett team som leds av MIT har upptäckt strukturen hos ett enzym som är avgörande för att upprätthålla en tillräcklig tillgång på DNA-byggstenar i mänskliga celler.
Deras nya struktur avslöjar också den troliga mekanismen för hur celler reglerar enzymet, känt som ribonukleotidreduktas (RNR). Betydligt nog, mekanismen verkar skilja sig från den för den bakteriella versionen av enzymet, vilket tyder på att det skulle kunna vara möjligt att designa antibiotika som selektivt blockerar det bakteriella enzymet.
"Människor har försökt ta reda på om det finns något tillräckligt annorlunda för att du skulle kunna hämma bakteriella enzymer och inte den mänskliga versionen, säger Catherine Drennan, en MIT-professor i kemi och biologi och en utredare vid Howard Hughes Medical Institute. "Genom att överväga dessa nyckelenzymer och ta reda på vad som är skillnaderna och likheterna, vi kan se om det finns något i det bakteriella enzymet som kan riktas mot småmolekylära läkemedel."
Drennan är en av de främsta författarna till studien, som visas i numret av tidskriften den 20 februari eLife . JoAnne Stubbe, Novartis professor i kemi Emerita vid MIT, och Francisco Asturias, en docent i biokemi vid University of Colorado School of Medicine, är också seniora författare. Uppsatsens huvudförfattare är MIT-forskaren Edward Brignole och före detta Scripps Research Institute postdoc Kuang-Lei Tsai, som nu är biträdande professor vid University of Texas Houston Medical Center.
Ett ovanligt enzym
RNR-enzymet, som finns i alla levande celler, omvandlar ribonukleotider (byggstenarna i RNA) till deoxiribonukleotider (byggstenarna i DNA). Celler måste hålla ett tillräckligt lager av dessa byggstenar, men när de samlar på sig för många, RNR stängs av av en deoxinukleotidmolekyl som kallas dATP. När fler deoxinukleotider behövs, en besläktad molekyl som kallas ATP binder till RNR och sätter på den igen.
En ovanlig egenskap hos RNR är att den kan katalysera produktionen av fyra olika produkter:nukleotidbaserna ofta förkortade som A, G, C, och T. 2016, Drennan upptäckte att enzymet uppnår detta genom att ändra sin form som svar på regulatoriska molekyler.
De flesta av forskarnas tidigare arbete med RNR-struktur har fokuserat på den version som finns i E coli . För dessa studier, de använde röntgenkristallografi, en teknik som kan avslöja den atomära och molekylära strukturen hos ett protein efter att det har kristalliserats.
I den nya studien, Drennan och hennes kollegor gav sig i kast med att undersöka den mänskliga versionen av RNR. Detta proteins struktur, som visade sig vara mycket annorlunda än bakterieversionen, visade sig svårfångad med röntgenkristallografi, som inte fungerar bra för proteiner som inte lätt kristalliserar. Istället, forskarna vände sig till en avancerad form av mikroskopi som kallas kryo-elektronmikroskopi (kryo-EM).
Tills nyligen, cryo-EM erbjöd vanligtvis en upplösning på cirka 10 till 20 ångström, som kan avslöja den övergripande formen av ett protein men ingen detalj om positionen och formen av mindre strukturella enheter inom det. Dock, under de senaste åren, tekniska framsteg har lett till en explosion av antalet strukturer som uppnår upplösningar på cirka 3 ångström. Det är tillräckligt högt för att spåra individuella proteinkedjor inom den större molekylen, såväl som inre strukturer såsom helixar och till och med sidokedjor av aminosyror.
Forskare visste redan att RNR består av två proteinsubenheter som kallas alfa och beta. Med hjälp av cryo-EM, MIT-teamet fann att den mänskliga versionen av enzymet bildar en ring gjord av sex av alfasubenheterna. När ATP, som aktiverar RNR, är bunden till enzymet, ringen är instabil och kan lätt öppnas, låter betasubenheten ta sig in i ringen. Denna sammanfogning av alfa och beta tillåter enzymets aktiva plats, ligger i beta-underenheten, att utföra de kemiska reaktioner som är nödvändiga för att producera deoxinukleotider.
Dock, när hämmaren dATP är närvarande, ringen blir mycket styvare och låter inte betasubenheten komma in. Detta förhindrar enzymet från att katalysera produktionen av deoxinukleotider.
Designa droger
Flera cancerläkemedel som nu används eller är under utveckling riktar sig mot den mänskliga versionen av RNR, stör cancercellers förmåga att fortplanta sig genom att begränsa tillgången på DNA-byggstenar. MIT-teamet har hittat bevis för att minst ett av dessa läkemedel, klofarabin difosfat, fungerar genom att inducera bildandet av stela 6-enheters alfaringar.
Denna 6-enhetsring finns inte i bakterieformen av RNR, som istället sätts ihop till en distinkt ring som innehåller fyra alfasubenheter och fyra betasubenheter. Detta innebär att det skulle kunna vara möjligt att designa antibiotika som riktar sig mot bakterieversionen men inte den mänskliga versionen, Drennan säger.
Hon planerar nu att undersöka strukturerna hos andra proteinmolekyler som är svåra att studera med röntgenkristallografi, inklusive proteiner med järnsvavelkluster, som finns i många metabola vägar. Mikroskopiarbetet i denna studie utfördes vid Scripps Research Institute, men när MIT:s nya MIT.nano-byggnad öppnar, det kommer att inrymma två kryo-EM-mikroskop som kommer att vara tillgängliga för MIT-gemenskapen såväl som andra potentiella användare inom industri och akademi.
"De tekniska framstegen som har gjort det möjligt för cryo-EM att nå så hög upplösning är verkligen spännande, Drennan säger. "Det börjar verkligen revolutionera studiet av biologi."