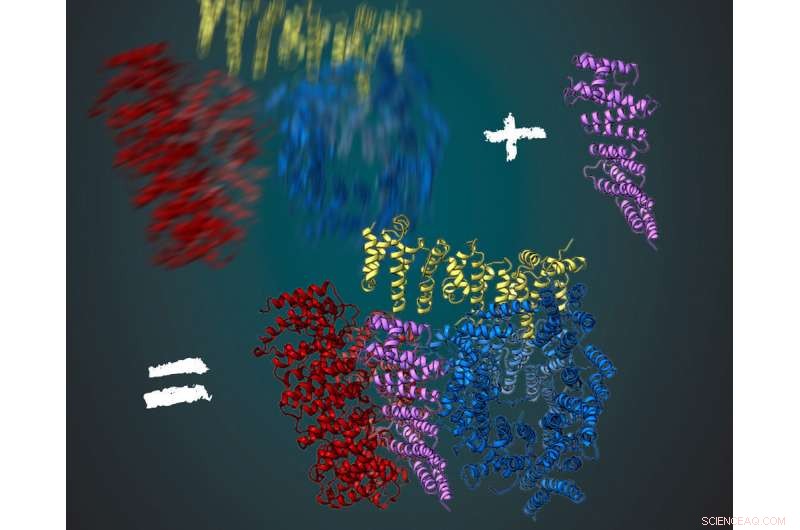
Proteinet huntingtin består av tre flexibla regioner, visas i rött, gult och blått. Tillsammans med sin interaktionspartner HAP40 (lila) är huntingtin mer stabil. Detta gjorde det möjligt för forskarna att härleda sin tredimensionella struktur med hjälp av kryoelektronmikroskopi. Kredit:MPI of Biochemistry/ Illustration:Gabriele Stautner, ARTIFOX
Mutationer på en enda gen, huntingtingenen, är orsaken till Huntingtons sjukdom. De leder till en felaktig form av motsvarande protein. Med hjälp av kryo-elektronmikroskopi har forskare från Max Planck Institute of Biochemistry i Martinsried och Ulm University nu avkodat det tredimensionella, molekylära strukturen hos det friska mänskliga huntingtinproteinet. Detta möjliggör nu dess funktionsanalys. En förbättrad förståelse för huntingtinproteinets struktur och funktion skulle kunna bidra till utvecklingen av nya behandlingsmetoder i framtiden.
Huntingtons sjukdom börjar ofta med känslomässiga störningar och kännetecknas av ofrivilliga muskelrörelser och förlust av mental förmåga. Tills idag, den neurologiska sjukdomen är en av de ärftliga sjukdomar som fortfarande är obotlig och dödlig. Proteinet HTT, även kallad huntingtin, spelar den centrala rollen i Huntingtons sjukdom. I 25 år har det varit känt att mutationer av huntingtingenen, som är ritningen för samma protein, orsakar Huntingtons sjukdom.
Även om forskare har arbetat med det i många år, det finns fortfarande många hinder att övervinna. Nu Rubén Fernández-Busnadiego från Max Planck Institute of Biochemistry och Stefan Kochanek, chef för avdelningen för genterapi vid Universitetssjukhuset Ulm, har lyckats avkoda molekylen, tredimensionell struktur av huntingtinproteinet.
Stefan Kochanek och hans team har arbetat med produktion och rening av jakttenn under lång tid. Vad har förhindrat en detaljerad analys av proteinet under de senaste decennierna? Fernández-Busnadiego, en expert på kryo-elektronmikroskopi, nämner två huvudfaktorer:"För det första, kryo-elektronmikroskopi har bara optimerats på senare år för att titta på proteinstrukturer med nästan molekylär upplösning. Det andra skälet är att huntingtinproteinet är mycket flexibelt i sin struktur. Precis nu, vi har också hittat en lösning för detta problem." Under analysen, bilder på proteinet tas från olika perspektiv under mikroskopet. Den tredimensionella molekylära strukturen kan beräknas från det stora antalet resulterande bilder. För detta, proteinet måste alltid vara i samma konformation. Fernández-Busnadiego förklarar:"Detta skulle likna en person som fotograferas i mörkret. Om personen inte står stilla ett tag, skottet kommer att bli suddigt."
För att få en tydlig bild, forskarna i Kochanek-labbet har letat efter andra proteiner som interagerar med huntingtin och stabiliserar det. Det fungerade för proteinet HAP40. "Huntingtin i samband med HAP40 är stabiliserat i en speciell konformation. medelvärde över många bilder, vi kunde härleda den tredimensionella strukturen, " sa Kochanek. "Om vi förblir i analogin med fotot i mörkret, då fungerar proteinet som en stol för den fotograferade. Sitter på den, personen rör sig mycket mindre och bilden blir mycket skarpare med samma exponeringstid, ", tillägger Fernández-Busnadiego.
"Även om vi har vetat under en tid att mutationen av huntingtingenen har allvarliga konsekvenser, vi vet fortfarande relativt lite om det friska proteinets funktion och uppgifter, " förklarar Kochanek. Proteiner är cellens molekylära maskiner. För att kunna fullgöra sina mångsidiga uppgifter, de har en viss tredimensionell struktur, liknande en specifik komponent i en maskin. "Nu när vi vet den exakta strukturen av huntingtin, vi kan vidare studera vilka områden av huntingtin som är särskilt viktiga och hur andra proteiner samverkar med huntingtin funktionellt. På detta sätt kunde strukturer härledas till att vara riktade terapeutiskt av vissa läkemedel."
Just nu, det händer mycket inom forskningen om Huntingtons sjukdom. Stort hopp riktas till en metod, som dämpar huntingtingenen med så kallade Antisense-Oligonukleotider för behandling av Huntingtons sjukdom. Dessa små molekyler minskar bildningen av huntingtinproteiner i cellerna, men läkemedlet kan inte skilja mellan det normala och det patologiskt förändrade huntingtinproteinet. Också av denna anledning, det är viktigt att lära sig mer om funktionen hos det friska huntingtinproteinet. Kochanek ser med tillförsikt in i framtiden:"Den avkodade strukturen kommer att ge oss ett stort steg framåt".
"Antisense-oligonukleotidbehandlingsförsöken genomförs för närvarande endast på väldigt få kliniker. Neurologiska universitetskliniken Ulm leder läkemedelstesterna för Tyskland. Några av de för närvarande granskade antisens-oligonukleotiderna minskar både bildningen av det normala och mutanta huntingtinproteinet, medan andra övervägande försöker sänka den förändrade huntingtinen. Det är för närvarande oklart om en partiell hämning av bildningen av normalt huntingtinprotein har nackdelar och tolereras utan oönskade biverkningar. Detta är ytterligare en anledning till varför det är viktigt att lära sig mer om huntingtinproteinets normala funktion. För detta ändamål, studien kommer att ge ett viktigt bidrag, säger Bernhard Landwehrmeyer, chefen för polikliniken Huntington vid neurologiska avdelningen vid University Medical Center Ulm.