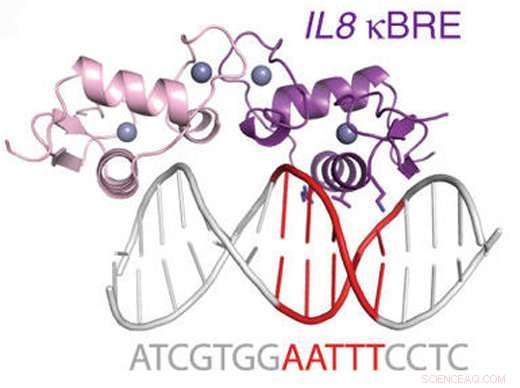
Figur:Diagram över glukokortikoidreceptorn som binder ett NF-kappaB-ställe. Upphovsman:Hudson et al, Nature Communications (2018).
Antiinflammatoriska läkemedel som dexametason kan ha skadliga biverkningar på huden, ben och metabolism. Strukturbiologisk forskning från Emory University School of Medicine har konsekvenser för den långvariga strävan att skilja dessa läkemedels fördelar från deras biverkningar.
Resultaten publicerades nyligen i Naturkommunikation .
Dexametason är ett syntetiskt glukokortikoidhormon, används för att behandla tillstånd som allergier, astma, autoimmuna sjukdomar och cancer. Det härmar verkan av det naturliga hormonet kortisol. Både kortisol och syntetiska hormoner verkar genom att binda glukokortikoidreceptor (GR) -proteinet.
GR kan binda DNA i två lägen. På vissa platser, det paras ihop eller "dimererar" - aktiverar gener. På andra, det binder en i taget, stänga av gener. För GR-inriktade läkemedel, biverkningarna antas komma från att slå på gener som är involverade i processer som metabolism och bentillväxt, medan de önskade antiinflammatoriska effekterna huvudsakligen beror på att stänga av inflammatoriska och immunsystemgener.
I deras nya tidning, Eric Ortlund, Ph.D., och kollegor rapporterar att GR:s förmåga att direkt binda DNA sträcker sig bredare än tidigare uppskattat. Den första författaren är Will Hudson, Ph.D., tidigare doktorand på Ortlund och nu postdoktor i Rafi Ahmeds laboratorium vid Emory Vaccine Center.
GR var känt för att störa ett annat viktigt DNA-bindande protein som kallas NFkB, en huvudregulator för inflammation. Ortlunds team fann att GR direkt kan binda en i taget till många av samma DNA -sträckor som NFkB interagerar med.
"Denna typ av interaktion, där GR agerar ett i taget - vi tror att det är drogerbart, säger Ortlund, som är docent i biokemi vid Emory University School of Medicine.
Han tillägger att uppsatsens resultat kan leda till ny tolkning av flera studier inom området för inflammatorisk genreglering. GR föreslogs tidigare att interagera med NFkB -webbplatser genom att "tethering, "baserat på protein-protein-interaktioner.
Ortlund konstaterar att mutationer som stör GR:s förmåga att dimerisera inte påverkar dess förmåga att minska inflammationen. Å andra sidan, mutationer som stör dess förmåga att binda DNA -folie både dess aktiverande och undertryckande funktioner.
Forskarna mätte affiniteten mellan GR-protein och DNA vid NFkB-bindande platser och visade att det liknade andra hormondrivna interaktioner som GR var välkänd för. De undersökte också sättet för interaktion mellan GR -protein och NFkB -bindande platser, med både röntgenkristallografi och NMR (kärnmagnetisk resonans). De visade att GR binder dessa sajter en i taget, i en region som faktiskt ligger mellan de två DNA -sträckorna som NFkB själv kontaktar.
Händer samma typ av interaktioner i celler? Hudson, Ortlund och kollegor omanalyserade data från andra för att visa att direkt DNA-bindning en och en av gangen av GR kan vara ansvarig för förtryck av många inflammationsgener.