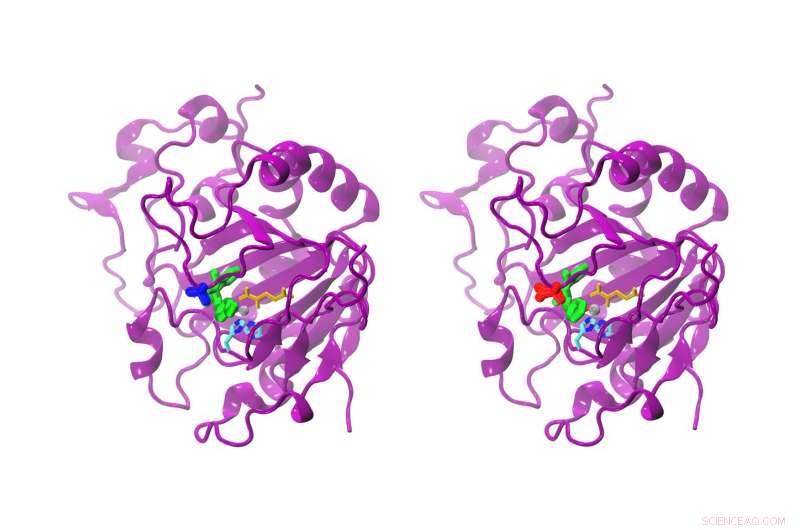
Medan skillnaden mellan den naturliga och den modifierade AsqJ bara är en aminosyra, reaktiviteten är helt klart annorlunda. Den naturliga AsqJ (vänster) har en valin i position 72 (blå). Den modifierade formen har en isoleucin (röd) vid position 72. Substratet i det aktiva stället är grönfärgat, alfa-ketoglutarat gul, järnatomen grå, och två histidinkedjor cyan och blå. Kredit:Sophie Mader/TUM
Praktiskt taget alla biokemiska processer involverar enzymer som påskyndar kemiska reaktioner. En forskargrupp från Münchens tekniska universitet (TUM) har nu för första gången dechiffrerat den molekylära mekanismen för enzymet AsqJ. Deras resultat kan öppna upp för nya alternativ i produktionen av farmaceutiskt aktiva molekyler.
Utan enzymer, naturen skulle stanna. Dessa små molekyler påskyndar biokemiska reaktioner eller gör dem möjliga i första hand. Men hur sker detta på molekylär nivå? "Att förstå enzymers exakta funktion är en av de största utmaningarna för modern biokemi, säger Ville Kaila, Professor i beräkningsbiokatalys vid Münchens tekniska universitet.
Forskargruppen ledd av Ville Kaila och Michael Groll, Professor i biokemi vid Münchens tekniska universitet, ha, för första gången, dechiffrerade mekanismen för enzymet aspoquinolon J (AsqJ), ett dioxygenas som aktiverar kolbindningar med syre.
Enzymet AsqJ är särskilt spännande eftersom det katalyserar en kaskad av kemiska reaktioner som i slutändan leder till bildandet av antibakteriella föreningar. Det upptäcktes för bara några år sedan i Aspergillus nidulans svamp. Forskarna kombinerade olika metoder för att avslöja hemligheterna i enzymet:Först, Alois Bräuer och Prof. Michael Groll använde röntgenkristallografi för att bestämma molekylens tredimensionella atomstruktur. Sophie Mader och Ville Kaila använde sedan denna information för att utföra kvantmekaniska simuleringar av dess biokemiska processer.
"Våra beräkningar illustrerar hur enzymet katalyserar bildandet av kinolonalkaloid, " rapporterar Kaila. "Små detaljer har fantastiska effekter:En liten förändring i underlaget, som att avlägsna en liten kemisk grupp, är tillräckligt för att praktiskt taget stoppa reaktionen."
Nästa, teamet designade beräkningsmässigt en ny variant av enzymet som katalyserar bildningen av kinolonalkaloider med det modifierade substratet. Detta nya enzym producerades experimentellt i bakterier och testades för dess funktionalitet. "Resultaten var imponerande:den förväntade reaktionen ägde rum efter bara några sekunder, " minns Bräuer.
"Detta experiment visar att vår metodik fungerar och är också lämpad för att representera funktionaliteten hos andra enzymer på molekylär nivå, " säger Ville Kaila. Enzymdesign är fortfarande på en grundläggande nivå, men det har en enorm potential. I framtiden, vi skulle kunna sträva efter att beräkningsdesigna medicinska läkemedel, till exempel.
"Arbetet visar att vår metodik är korrekt och även väl lämpad för att studera funktionaliteten hos andra enzymer på molekylär nivå, " säger Ville Kaila. Enzymdesign är fortfarande grundforskning - men den har enorm potential. Ett mål med framtida forskning kommer att vara att designa enzymer i en dator för att, till exempel, producera nya läkemedel.